Koagulační kaskáda
| Stránky: | POSTUDIUM |
| Kurz: | Koagulace – fyziologie hemostázy |
| Kniha: | Koagulační kaskáda |
| Vytiskl(a): | Nepřihlášený host |
| Datum: | sobota, 7. června 2025, 21.33 |
Popis
V krvi je obsaženo mnoho různých plazmatických proteinů, k nimž patří i koagulační faktory a jejich inhibitory, které tvoří úzce souvisící sled reakcí vedoucích k tvorbě trombinu a následné produkci fibrinu. Aktivační proces je kaskádou proteolytických štěpných reakcí ve specifických místech peptidu, takže se z koagulačně neaktivních faktorů stávají jejich aktivované formy. Tento mechanizmus aktivace se podobá procesu aktivace komplementu nebo procesu regulace krevního tlaku systémem renin/angiotenzin.
Enzym je v této reakci aktivovaný koagulační faktor a substrátem je dosud inaktivní prekurzor jiného koagulačního faktoru, který se stává aktivním poté, co se část jeho neaktivní molekuly proteolyticky naštěpila. Naštěpení indukuje konformační změny, které obnaží aktivní místa skrytá uvnitř proenzymu. Všechny koagulační faktory s proteázovou aktivitou patří do společné třídy serinových proteáz, které jsou charakterizovány určitou stejnou sekvencí aminokyselin v řetězci.
Kromě fyziologické aktivace mohou plazmatické koagulační faktory aktivovat i proteázy obsažené v mikroorganizmech, nádorových buňkách, leukocytech nebo poraněných tkáních. Speciálním případem aktivace serinových proteáz jsou hadí jedy, které významně ovlivňují hemostázu a používají se jako aktivátory koagulačních faktorů in vitro.
Koagulační faktory
Koagulační faktory představují skupinu plazmatických proteinů. Většina z nich ( kromě FII a FI) cirkuluje v plazmě ve velmi nízkých koncentracích. Kromě tkáňového faktoru vázaného na plazmatickou membránu vyžadují ostatní plazmatické koagulační faktory aktivační krok. Prekalikrein, vysokomolekulární kininogen a FXII tvoří tak zvané faktory kontaktní fáze uplatňující se při fyziologické aktivaci hemostázy .
Koagulační faktory II,VII, IX a X jsou K vitamín dependentní. To znamená, že vitamín K umožňuje sérii reakcí, tzv.gamakarboxylaci tzv. Gla-domény (Gla je zkratka pro gama karboxyglutamovou kyselinu) proteinových řetězců těchto faktorů a tímto procesem se koagulačně neaktivní prekurzory, tzv. PIVKA faktory ( protein induced by vitamin K absence), přemění na koagulačně aktivní, které jsou schopny vázat zejména Ca2+ ionty.
Aktivace krevního srážení je proces probíhající v minimální míře v plazmě kontinuálně. Bez poškození cévní stěny nebo jiných podnětů k aktivaci hemostázy nedojde. Jediný koagulační faktor, který se v plazmě vyskytuje v aktivované formě, je minimální hladina FVIIa, která reprezentuje jen nepatrnou část celkové koncentrace FVII v plazmě. Nejdůležitější jsou dvě základní aktivační cesty
-
aktivace tkáňovým faktorem (zevní aktivační cesta)
-
aktivace kontaktem s nefyziologickými povrchy (vnitřní aktivační cesta)
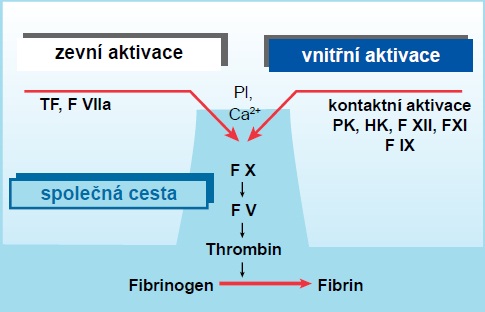
Tyto dva mechanizmy aktivace nejsou od sebe striktně odděleny, naopak se překrývají a mezi sebou reagují. Obě cesty se setkávají na úrovni aktivace FX a následných kroků a konečným produktem obou cest je zesíťovaný fibrin.Toto dělení na zevní a vnitřní aktivační cestu se používá z důvodů principu vyšetřovacích koagulačních testů pro diagnostiku poruch krevního srážení.
In vivo funguje proces krevního srážení jako jednotný celek. Didakticky rozlišujeme při popisu procesu krevního srážení fázi iniciační, amplifikační a propagační.
Zevní cesta krevního srážení
Zevní cesta krevního srážení (fáze iniciační, spouštěcí) je stěžejní, fyziologická a je spouštěna téměř exkluzivně prostřednictvím tkáňového faktoru. Tkáňový faktor (TF) je membránový protein, který se za fyziologických podmínek nevyskytuje ani na povrchu endotelu ani na povrchu bílých krvinek ani v plazmě. Endotel je stejně jako většina tkání je na TF bohatý. Po vazbě TF na FVIIa vzniká komplex, který přímo aktivuje FX na aktivovanou formu Xa za podmínky, že jsou v daném místě k dispozici negativně nabité fosfolipidy z destičkové membrány a kalciové ionty.
Poločas FVIIa je 2 hodiny a velmi nízká stálá koncentrace FVIIa v plazmě umožňuje jeho vychytání v místech, kde došlo k expresi TF.
Schematicky lze tento proces znázornit
TF+ FVIIa + FX (Ca2+ + PL) → FXa
↓
FXa + FVa (Ca2+ + PL) + FII→ FIIa
↓
FIIa + fbg → fibrin
Skutečnost je samozřejmě mnohem složitější a výsledná produkce fibrinu je výsledkem zapojení mnoha pozitivních i negativních zpětnovazebných reakcí. Pozitivní feedback znamená zapojení autoaktivačních procesů za účelem posílení tvorby koagula (amplifikace, proto fáze amplifikační ). Cílem je dosáhnout při minimálním uvolnění TF maximálního účinku a tím je dostatečná tvorba zesíťovaného fibrinu a minimální krevní ztráty.
Naopak negativní zpětnovazebné mechanizmy se uskutečňují prostřednictvím přirozených inhibičních mechanizmů, jejichž cílem je utlumení koagulační reakce poté, co bylo dosaženo vzniku pevného koagula.
Koagulační reakce probíhá aktivací proenzymů ve specifickém štěpném místě, tato proteolýza způsobí aktivaci na aktivovanou formu daného faktoru, který se stává proteolytickým enzymem štěpícím koagulační proenzym o úroveň nižší (autoaktivace).
V zevním systému je nejdůležitějším zpětnovazebným mechanizmem aktivace FV generovaným trombinem. FVa spolu s Ca2+ ionty a PL (fosfolipidy) aktivuje protrombin mnohem efektivněji než sám FXa.
Komplex FXa, FVa, PL a Ca2+ionty (protrombináza) je nejúčinnějším zdrojem stěžejní koagulační bílkoviny - trombinu, v němž je FXa chráněn před inaktivací antitrombinem.
Vnitřní (kontaktní) cesta krevního srážení
Kontaktní fáze krevního srážení, vnitřní aktivace koagulace
Kontakt krve s umělými povrchy zejména těmi, které jsou negativně nabité (např.sklo nebo umělá hmota), spouští řetězovou reakci konformačních změn. Negativně nabitými biologickými povrchy mohou být za jistých okolností složky buněčné membrány, které jsou do oběhu vyplavovány po poranění cévní stěny.
V přítomnosti vysokomolekulárního kininogenu (HMWK) se prekalikrein aktivuje na kalikrein, který pak velmi rychle aktivuje FXII. FXIIa pak aktivuje FXI na FXIa. FXIa aktivuje FIX na FIXa.
Všechny následné kroky vyžadují kalciové ionty a fosfolipidy.
FIXa aktivuje FX, ale tato reakce není příliš efektivní. Jakmile je vytvořen trombin, FIXa formuje komplex s FVIIIa a spolu s fosfolipidy a kalciovými ionty jako tzv. tenáza aktivuje FX velmi účinně.
Vnitřní cesta, zejména kontaktní fáze, se zdá být ve srovnání se zevní aktivační cestou méně významná. Hraje však roli v okamžiku, je-li krev vystavena kontaktu s nebiologickými povrchy, např. při mimotělním oběhu. Za těchto okolností je nutno kontaktní fázi inhibovat farmakologicky.
Faktory kontaktní fáze ovlivňují řadu důležitých biologických mechanizmů jako aktivaci fibrinolýzy, regulaci krevního tlaku systémem renin/ angiotenzin a jsou i součástí aktivace komplementu.
Tvorba a zesíťování fibrinu (fáze propagační)
Tvorba zesíťovaného fibrinu je konečným produktem kaskádovitých koagulačních reakcí, kdy se v posledním kroku konvertuje rozpustný fibrinogen na nerozpustný fibrin. Fibrinogen (FI) je velký multimerní plazmatický protein složený ze 2 řetězců alfa, beta a gama. Jednotlivé proteinové řetězce jsou pak při polymerizaci spojeny disulfidickými můstky.
Polymerizací se vytváří pevná, nerozpustná a nepropustná síť pevně pospojovaných bílkovinných řetězců.
FXIII
FXIII je kalcium dependentní koagulační faktor. V plazmě je FXIII vázán na fibrinogen a po aktivaci způsobuje překřížení fibrinových vlákem a formaci síťovité struktury krevní sraženiny (koagula), do které začleňuje i alfa2 - antiplazmin jako stěžejní inhibitor fibrinolýzy a TAFI (trombinem aktivovaný inhibitor fibrinolýzy). Tyto inhibitory stabilizují koagulum a chrání ho před předčasným rozpuštěním.
Koagulum je trojrozměrný útvar obsahující i krevní elementy jako trombocyty, erytrocyty a bílé krvinky. Díky zpočátku inhibované fibrinolýze je koagulum nějakou dobu stabilní. Protože obsahuje stále ještě aktivní trombin, může se koagulum v určitých místech rozpustit a odtrhnout a tyto odtržené kousky (tzv.emboly) mohou krevním řečištěm cestovat po směru krevního proudu a jako vysoce trombogenní materiál se mohou v cévním řečišti zachytit a způsobit překážku toku krve a způsobit novou trombembolickou příhodu (cévní mozkovou příhodu nebo plicní embolii).
Přímá fixace fibrinových vláken na různé buněčné povrchy jako destičky, fibroblasty, buňky hladké svaloviny a adhezívní proteiny chrání poraněné místo cévní stěny mechanicky i chemicky, takže kromě redukce krevní ztráty brání zenesení infekce a embolizaci.
1. Koagulační kaskáda
2. Koagulační faktory
3. Aktivace koagulační kaskády
- aktivace tkáňovým faktorem (zevní aktivační cesta)
- aktivace kontaktem s nefyziologickými povrchy (vnitřní aktivační cesta)
4. Vnitřní koagulační cesta
Vnitřní (kontaktní) cesta krevního srážení
Kontaktní fáze krevního srážení, vnitřní aktivace koagulace
Kontakt krve s umělými povrchy zejména těmi, které jsou negativně nabité (např.sklo nebo
umělá hmota), spouští řetězovou reakci konformačních změn. Negativně nabitými biologickými
povrchy mohou být za jistých okolností složky buněčné membrány, které jsou do oběhu vyplavovány po poranění cévní stěny.
V přítomnosti vysokomolekulárního kininogenu (HK) se prekalikrein (PK) aktivuje na kalikrein, který velmi rychle aktivuje FXII. FXIIa pak aktivuje FXI na FXIa. FXIa aktivuje FIX na FIXa.
Všechny následné kroky vyžadují kalciové ionty a fosfolipidy.
FIXa aktivuje FX, ale tato reakce není příliš efektivní. Jakmile je vytvořen trombin, FIXa formuje
komplex s FVIIIa a spolu s fosfolipidy a kalciovými ionty jako tzv. tenáza aktivuje FX velmi
účinně.
Vnitřní cesta, zejména kontaktní fáze, se zdá být ve srovnání se zevní aktivační cestou
méně významná. Hraje však roli v okamžiku, je-li krev vystavena kontaktu s nebiologickými
povrchy, např. při mimotělním oběhu. Za těchto okolností je nutno kontaktní fázi inhibovat
farmakologicky.

Faktory kontaktní fáze ovlivňují řadu důležitých biologických mechanizmů jako aktivaci
fibrinolýzy, regulaci krevního tlaku systémem renin/ angiotenzin a jsou i součástí aktivace
komplementu.