Nádorové markery
| Stránky: | POSTUDIUM |
| Kurz: | Nádorové markery |
| Kniha: | Nádorové markery |
| Vytiskl(a): | Nepřihlášený host |
| Datum: | čtvrtek, 19. února 2026, 00.50 |
Popis
Marie Karlíková, Ondřej Topolčan, Šárka Svobodová
Podle klasické definice jsou nádorové markery laboratorně prokazatelné biochemické látky, přítomné v organismu v důsledku vzniku a vývoje maligního procesu. Nádorové markery jsou prokazatelné v séru či jiných tělesných tekutinách (sérové či humorální nádorové markery) nebo se vyskytují v nádorových buňkách či na jejich povrchu (tkáňové či celulární nádorové markery). (V následujícím textu je věnována pozornost především sérovým nádorovým markerům, rutinně stanovovaným v imunoanalytické laboratoři. Tkáňové biomarkery jsou zmíněny pouze okrajově).
Obsah
- Co je nádorový marker?
- Indikace vyšetření nádorových markerů
- Laboratorní stanovení nádorových markerů
- Interpretace výsledku
- Klasifikace a charakteristiky nádorových markerů
- Onkofetální antigeny
- Cytokeratinové nádorové markery
- Enzymy
- Hormony
- Ostatní blíže nespecifikované látky
- Nádorové markery spojené s buněčnou proliferací, diferenciací a metastazováním
- Tkáňové nádorové markery
- Markery stanovované metodami molekulární biologie
- Cirkulující nádorové buňky (CTC)
- Shrnutí
- Doporučená literatura
Co je nádorový marker?
Podle klasické definice jsou nádorové markery laboratorně prokazatelné biochemické látky, přítomné v organismu v důsledku vzniku a vývoje maligního procesu.
Nádorové markery jsou prokazatelné v séru či jiných tělesných tekutinách (sérové či humorální nádorové markery) nebo se vyskytují v nádorových buňkách či na jejich povrchu (tkáňové či celulární nádorové markery).
(V následujícím textu je věnována pozornost především sérovým nádorovým markerům, rutinně stanovovaným v imunoanalytické laboratoři. Tkáňové biomarkery jsou zmíněny pouze okrajově).
Jaký by měl být ideální marker?
Optimální požadavky kladené na ideální nádorový marker jsou následující:
- je produkován pouze u maligních onemocnění
- je orgánově specifický
- vyskytuje se ve vysokých koncentracích v biologických tekutinách
- koreluje
- s velikostí nádoru
- se stádiem onemocnění
- s prognózou
- s účinností terapie.
V klinické praxi neexistuje v současné době žádný nádorový marker, který by tato kriteria splňoval!
Nádorové markery nejsou ani nádorově, ani orgánově specifické. Je proto nutné si vždy uvědomit optimální indikace a současně i limitace těchto vyšetření. Správně indikované vyšetření nádorových markerů může přispět především k včasnému záchytu recidivy či progrese onemocnění a tím i k rychlejšímu terapeutickému zákroku, který může prodloužit život nemocného.
Indikace vyšetření nádorových markerů
Při indikaci vyšetření nádorových markerů se velice často chybuje. Důvodem indikace ve vysokém procentu vyšetření je: „mám podezření na nádor, a proto vyšetřím co nejvíce nádorových markerů a ono něco vyjde“. V praxi často zazní okřídlená věta „sestro naberte ty nádorové markery!“ Není řečeno, jaké, a tudíž sestra zatrhne všechny markery, které laboratoř stanovuje.
V praxi je vhodné se řídit:
- klinickou otázkou, tj. proč chceme stanovit nádorový marker a co od výsledku očekáváme,
- limitacemi vyšetření,
- frekvencí vyšetření.
Klinická otázka
Klinická otázka by měla být základem uvažování lékaře, protože s ní úzce souvisí interpretace výsledků vyšetření. Možné klinické situace, kdy a jak vyšetřovat nádorové markery, jsou uvedeny v tabulce 1 a podrobněji popsány v další části kapitoly.
Tabulka 1. Klinické situace pro stanovení nádorových markerů
|
Klinická otázka |
Očekávaná odpověď |
Správnost indikace |
Poznámka |
|
Podezření, že někde v těle nemocného je nádor (anemie apod.) |
Diagnóza nádoru a jeho lokalizace |
Ne |
Výjimečně, pokud je nemocný v těžkém stavu |
|
Screening |
|
Ne |
I když nedosahuje kriterií pro screening, je zatím jediným doporučeným screeningovým markerem FOBT (Fecal Occult Blood Testing) a fekální imunochemický test pro screening kolorektálního karcinomu (Sturgeon a Diamandis 2010). |
|
Aktivní vyhledávání familiárních typů karcinomu |
Časný záchyt onemocnění |
Omezeně |
Někdy se mluví o screeningu v rizikových skupinách |
|
Vyšetření u prekarcenozy |
Časný záchyt maligního zvratu |
Ne |
Nízká incidence maligního zvratu k frekvenci prekarcenozy |
|
Časná diagnostika |
Diagnóza nádoru nebo odlišení benigního od maligního nádoru |
Omezeně |
Pouze v případě karcinomu prostaty či ovarií |
|
Primární a diferenciální diagnostika |
Potvrzení diagnózy nebo event. usnadnění diferenciální diagnózy |
Omezeně |
spíše pro diferenciální diagnostiku. |
|
Upřesnění diagnózy |
Histologický typ |
Omezeně |
|
|
Prognóza onemocnění |
Agresivita nádoru |
Omezeně |
|
|
Volba typu léčby |
Chirurgická x medikamentózní léčba |
Ne |
|
|
Efekt operace |
Residuální nádorová tkáň |
Omezeně |
|
|
Pooperační follow up |
Jedná se o remisi x progresi |
Ano |
Optimální indikace k vyšetření nádorových markerů |
|
Podezření na recidivu |
Potvrzení recidivy |
Ano |
Optimální indikace k vyšetření nádorových markerů |
|
Volba onkologické terapie |
Volba biologické léčby |
Ano |
Optimální indikace k vyšetření nádorových markerů |
|
Predikce efektu léčby |
Přežití, DFI (disease free interval) |
Omezeně |
|
|
Monitorace léčby |
Je léčba efektní |
Ano |
|
V praxi je nejvýznamnější indikací pro sledování nádorového markeru monitorování průběhu onemocnění (follow up) a s tím úzce související diagnostika recidivy nebo progrese. Dodržuje se určité schéma, které je odvozeno ze senzitivit získaných z předoperačních vyšetření nebo dlouhodobých monitorovacích studií. Používají se hlavní a doplňkové nádorové markery.
Limitace vyšetření
Tabulka 2. Limitace vyšetření nádorových markerů
|
Klinická otázka |
Limitace |
|
Podezření z nádorového onemocnění |
Pro generalizovaný nádor svědčí extrémní zvýšení více markerů současně. Nelze použít pro tyto účely CA 125. |
|
Screening |
Nelze dosáhnout u žádného markeru 95 % sensitivity při 97 % specifitě. |
|
Aktivní vyhledávání familiárních typů karcinomu |
- vrozené mutace BRCA1 a BRCA2 pro screening karcinomu prsu u příbuzných nemocné s uvedenou diagnózou (Sturgeon a Diamandis 2010) - kolorektální karcinom |
|
Vyšetření u prekarcenozy
|
V zemích jihovýchodní Asie se provádí systematické vyšetření u všech nemocných s cirrhosou jater, protože maligní zvrat se vyskytuje u 40 % osob (v České republice jen u cca 5 % osob, proto je zde systematické vyšetření neúčelné.) |
|
Časná diagnostika |
U vybraných nádorů a v definovaných věkových skupinách |
|
Primární a diferenciální diagnostika |
U nádorů testes, chorioepiteliomu, nádorů plic |
|
Upřesnění diagnózy |
U nádorů plic, neuroendokrinních nádorů |
|
Prognóza onemocnění |
Zatím omezeně, spíše markery buněčné prokazované imunohistochemicky nebo metodami molekulární biologie, korelace s TNM klasifikací a stadiem onemocnění existuje u pokročilých stadií, kde to nemá klinický význam |
|
Volba typu léčby |
Nevhodné, protože korelace s výší hladiny markeru je sporná a nelze usuzovat z výše hladiny markerů na generalizaci onemocnění a tím nevhodnost chirurgické léčby |
|
Efekt operace |
Z poklesu markeru lze usoudit na efekt operace, pokud markery byly zvýšeny před operací. Průkaz reziduální tkáně je možný v ojedinělých případech karcinomů ovarií či kolorekta, ale vyžaduje velkou zkušenost s interpretací výsledků. |
|
Pooperační follow up |
problém pouze u nádorů neprodukujících nádorové markery (např aplastické nádory) |
|
Podezření na recidivu |
problém pouze u nádorů neprodukujících nádorové markery (např aplastické nádory) |
|
Volba onkologické terapie |
Problém pouze tehdy, neexistuje-li vhodný marker pro daný typ onemocnění |
|
Predikce efektu léčby |
Záleží na typu léčby |
|
Monitorace léčby |
Záleží na typu léčby |
Frekvence vyšetření
Jednorázové vyšetření má jen velmi omezený význam. Základem využití nádorových markerů v praxi je dynamické sledování. Úvodní hodnotou by měla být hodnota před léčbou – tj předoperační hodnota nebo hodnota před zahájením onkologické léčby .
Vyšetření předoperační hodnoty má dvojí význam. Jak naše dlouhodobé zkušenosti ukazují, pokud je nádorový marker zvýšen předoperačně, bude zvýšen i při progresi, a to v 88 – 95 %, naproti tomu tam, kde předoperační hodnoty byly v normě, dojde při progresi k vzestupu jen v 30 %. Předoperační vyšetření vhodně voleného nádorového markeru umožňuje do jisté míry individualizovat dispenzární péči. Při předoperační pozitivitě markeru se na něj můžeme spolehnout i při follow up, při negativitě by měl být dán důraz především na klinické sledování nemocného, eventuelně na zobrazovací techniky. Kromě toho, absolutní výše sérové hladiny nádorového markeru v určitých případech souvisí s prognózou nemocného.
Při folow up onemocnění provádíme vyšetření nádorových markerů nejčastěji jedenkrát za 3 – 4 měsíce v prvních třech letech po vzniku nádorového onemocnění, později stačí dvakrát do roka. Frekvence však závisí i na vývoji onemocnění. Při progresi nádoru je samozřejmě nutné frekvenci vyšetření zvýšit na jedenkrát za měsíc nebo jedenkrát za dva měsíce.
Doporučení expertních skupin
Pro klinické využití nádorových markerů jsou vydávána doporučení expertních skupin: jednak světových odborných společností, zejména European Group on Tumor Markers (EGTM), American Society of Clinical Oncology (ASCO) a National Academy of Clinical Biochemistry (NACB), jednak národních odborných společností. V České republice bylo v roce 2008 vydáno a v roce 2012 aktualizováno Doporučení České společnosti klinické biochemie (ČSKB ČLS JEP), České onkologické společnosti (ČOS ČLS JEP) a České společnosti nukleární medicíny (ČSNM ČLS JEP) - sekce imunoanalytických metod k využití nádorových markerů v klinické praxi, které vychází z dokumentů publikovaných uvedenými třemi expertními skupinami a aplikuje je na podmínky v ČR. V řadě případů je indikace k vyšetření nádorových markerů v ČR méně přísná, než je tomu v zahraničí.
Laboratorní stanovení nádorových markerů
Stanovení biochemických markerů je relativně jednoduché, markery se stanovují v tělních tekutinách. Provádí se ve specializované laboratoři s použitím imunoanalytických metod.
Předpokladem správné interpretace výsledku v laboratoři je respektování podmínek preanalytiky, analytiky a samozřejmě existující interní a externí kontroly kvality.
Na rozdíl od enzymů, hormonů a dalších analytů jsou nádorové markery relativně odolné zevním vlivům. Hemolýza zvyšuje významnou měrou pouze sérovou hladinu NSE, což je způsobeno jeho vysokou hladinou v erytrocytech. Z analytického hlediska není třeba odběr krve nalačno, pro standardizaci výsledků je doporučeno provádět odběr vždy v ranních hodinách.
Nádorové markery podléhají relativně minimální denní variabilitě, výjimkou jsou cytokeratiny a thymidinkináza, kde se denní variabilita podle našich zkušeností pohybuje mezi 10 – 25 %. Biologická variabilita je různá a pohybuje se od 5 – 70 %, extrémně vysokou biologickou variabilitu (až 300 %) má podle některých autorů CA72 – 4.
Při monitoraci onemocnění je důležité stanovovat nádorové markery jednou metodikou v jedné laboratoři.
Negativní výsledek stanovení ještě neznamená, že nádorové onemocnění není přítomno.
Pro kvalitní klinické zhodnocení je nutná úzká spolupráce laboratoře a klinického pracoviště.
Interpretace výsledku
Pro klinické zhodnocení vyšetření nádorových markerů se používá cut off (diskriminační hladina). Při primární diagnostice je hladina cut off definována jako hladina markeru, pod kterou je 95 % zdravých lidí, eventuelně pacientů s benigním onemocněním, při follow up nádoru nebo monitoraci léčby je definována jako hladina markeru, pod kterou leží 95 % hodnot pacientů v kompletní remisi.
Pokud jsou hodnoty markeru lehce zvýšené nad cut off (do 20%), mělo by se vyšetření opakovat pro ověření, zda je výsledek spolehlivý a není pouze variabilitou okolo hraniční hodnoty. Zvýšení hodnoty o 20-200% může svědčit pro nádorové onemocnění, pokud vyloučíme všechny příčiny falešné pozitivity výsledku. Zvýšení o více než 200% je extrémní zvýšení, svědčí většinou pro pokročilý nádorový proces, eventuelně generalizaci nádoru. Existují však situace, kdy mohou být extrémně vysoké hodnoty způsobeny benigním onemocněním (především v případě CA 125, kdy při zánětech vaječníků nebo dráždění serózních blan /pohrudnice, pobřišnice/ můžeme naměřit až několikatisícové hodnoty).
Pro interpretaci výsledků stanovení je důležitá senzitivita a specificita vyšetření (při daném cut off) a optimálně vyjádření poměru mezi těmito dvěma parametry křivkou ROC.
Senzitivita stanovení je pravděpodobnost, že pacient s pozitivním výsledkem testu má hledané nádorové onemocnění (podíl správně pozitivních výsledků, true positive rate).
Specificita stanovení je pravděpodobnost, s jakou má pacient bez diagnostikovaného maligního onemocnění negativní výsledek laboratorního testu (podíl správně negativních výsledků, true negative rate).
Pozn.: V případě nádorových markerů je doporučeno stanovovat senzitivitu při 95% specificitě.
Kromě správně pozitivních výsledků (SP) (pozitivní výsledek testu v případě jedince s diagnostikovaným maligním onemocněním) a správně negativních výsledků (SN) (negativní výsledek testu u jedince bez maligního onemocnění) dostaneme i falešně pozitivní (FP) výsledky (pozitivní výsledek testu u jedince bez maligního onemocnění) a falešně negativní (FN) výsledky (negativní výsledek testu u jedince s diagnostikovaným maligní onemocněním). Falešně pozitivní výsledky mohou být způsobeny různými faktory, např. benigním onemocněním atd.
Křivka ROC představuje vztah mezi senzitivitou a 100%-specificitou testu (tj. mezi podílem správně pozitivních a podílem falešně pozitivních výsledků). Čím větší je plocha pod křivkou ROC, tím větší je podíl správně pozitivních výsledků a tedy daný test má větší efektivitu. Příklad křivky ROC je uveden na obrázku 1. Lze z něj vyčíst, že v daném případě mělo největší efektivitu stanovení IL-6.
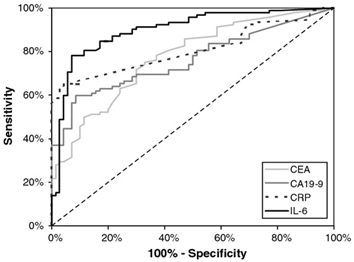
Obrázek 1. Křivky ROC pro markery CEA, CA 19-9, CRP a IL-6 u pacientů s karcinomem žaludku (zdroj: www.springerimages.com).
Senzitivita a specificita jsou charakteristiky samotného testu. Prediktivní hodnoty, tj. pravděpodobnosti, zda jedinec skutečně má či nemá maligní onemocnění, jsou však velmi silně závislé na prevalenci nemoci.
Pozitivní prediktivní hodnota (PV+) je pravděpodobnost, že osoba je opravdu nemocná, když test reagoval pozitivně. Definujeme ji jako SP/(SP+FP), čili počet správně pozitivních výsledků u nemocných dělený celkovým počtem pozitivních výsledků testu.
Negativní prediktivní hodnota (PV-) je pravděpodobnost, že osoba nemá sledovanou nemoc při negativním výsledku testu. Definujeme ji jako SN/(SN+FN), čili počet správně negativních výsledků u zdravých dělený celkovým počtem negativních výsledků testu.
Praktický význam diagnostického testu tedy záleží na senzitivitě, specificitě a prevalenci, které plně určují prediktivní hodnoty.
Klasifikace a charakteristiky nádorových markerů
V této kapitole je uveden přehled nádorových markerů, které jsou využívány v in vitro diagnostice nebo jsou ve stadiu evaluace či výzkumu. Nejčastěji užívané markery jsou uvedeny spolu s jejich stručným popisem a klinickým využitím.
Sérové nádorové markery
Sérové nádorové markery můžeme rozdělit na:
- onkofetální antigeny
- cytokeratiny
- enzymy
- hormony
- ostatní nespecifikované látky
- markery spojené s buněčnou proliferací, diferenciací a metastazováním.
Onkofetální antigeny
Většina nádorových markerů patří mezi onkofetální antigeny. Jde o látky, které nacházíme v poměrně vysokých koncentracích u plodu, kde se vyskytují na povrchu diferencujících se buněk (diferenciační antigeny) a hrají významnou roli ve vývoji plodu. U zdravých dospělých osob je jejich hladina velice nízká a přesná biologická funkce není známa. Při většině nádorových onemocnění se jejich aktivita výrazně zvyšuje. Typické pro ně je, že se vyskytují především u dobře diferencovaných nádorů a jejich hladina většinou koreluje s velikostí nádorové masy. Jejich stanovení má význam zejména pro určení prognózy nádorového onemocnění a kontrolu terapie.
AFP (alfa-feto-protein)
AFP (alfa-feto-protein) je glykoprotein, strukturou i funkcí u plodu je podobný albuminu. Je produkován ve vyvíjejícím se embryu v žloutkovém vaku a pak játry plodu. V séru matky, kam přechází přes placentu,je důležitým ukazatelem fyziologického vývoje gravidity. U zdravých dospělých je jeho syntéza minimální. Zvýšená exprese AFP je charakteristická pro většinu hepatocelulárních karcinomů a hepatoblastomů, a také u nádorů zárodečných buněk (neboli germinálních nádorů), především u embryonálního karcinomu, tumorů žloutkového vaku a teratomů.
Tabulka 3. Referenční hodnoty AFP v séru
|
|
AFP (kIU/L) |
|
Normální hodnoty |
0-5 |
|
Hraniční hodnoty |
5-10 |
|
Patologické hodnoty |
> 10 |
Klinické využití AFP jako nádorového markeru je shrnuto v tabulce 4. Falešně pozitivní hodnoty nalézáme u akutní virové i chronické hepatitidy, u cirhózy i nekrózy jater a v těhotenství.
Tabulka 4. AFP a jeho klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Screening |
Karcinom jater, germinální nádory - pouze u rizikových skupin či symptomatických nemocných (např. s cirhózou jater), platí pouze pro jihovýchodní Asii |
|
Diagnostika |
Pouze v případě onemocnění jater (spolu s dalšími markery) |
|
Diferenciální diagnostika |
Germinální nádory – odlišení od ostatních nádorů |
|
Monitorace onemocnění |
Hepatocelulární karcinom a hematoblastom Germinální nádory ovariální a testikulární |
|
Monitorace léčby |
Hepatocelulární karcinom a hepatoblastom Germinální nádory |
CA 125
Karbohydrátové nádorové antigeny CA 125, CA 15-3, CA 19-9 a CA 72-4 jsou členy mucinové rodiny glykoproteinů.
CA 125 se u plodu a v menší koncentraci u dospělých vyskytuje v epiteliálních buňkách dýchacího ústrojí. Výrazně vysoké hladiny se nachází v séru těhotných a v mateřském mléce. U maligních onemocnění je syntetizován především v epiteliálních buňkách karcinomů ovarií, zvýšené hladiny se vyskytují i u dalších nádorů (karcinomů mléčné žlázy, pankreatu, plic, žlučových cest, hepatocelulárního karcinomu).
Falešně pozitivní výsledky se mohou vyskytnout v případě chronických onemocnění jater či u peritonitidy, benigních onemocnění ovarií a endometria, leiomyomu, selhání ledvin, těhotenství, v 1. polovině menstruačního cyklu.
Tabulka 5. Referenční hodnoty CA 125 v séru
|
|
CA 125 (kIU/L) |
|
Normální hodnoty |
0-30 |
|
Hraniční hodnoty |
30-40 |
|
Patologické hodnoty |
> 40 |
Klinické využití CA 125 je uvedeno v tabulce 6. Větší výpovědní hodnotu než vyšetření samotného CA 125 má jeho stanovení spolu s nádorovým markerem HE4 a výpočet indexu ROMA (Risk of Ovarian Malignancy Algorithm), který indikuje riziko ovariálního karcinomu s ohledem na menopauzální status (Kučera R. et al. 2012).
Tabulka 6. CA 125 a jeho klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Aktivní vyhledávání |
Ovariální karcinom – pouze v případě genetické zátěže (alespoň jeden příbuzný) syndromem ovariálního karcinomu je doporučeno stanovit CA 125 (spolu s vaginálním ultrazvukovým vyšetřením) každoročně. |
|
Diagnostika |
Ovariální karcinom – v kombinaci s HE4 (ROMA index), především u postmenopauzálních žen |
|
Diferenciální diagnostika |
Ovariální karcinom – v kombinaci s HE4 (ROMA index), především u postmenopauzálních žen |
|
Monitorace onemocnění |
Kontrola po operaci maligního ovariálního karcinomu (průkaz reziduální nádorové tkáně) Ovariální karcinom - v kombinaci s HE4 (ROMA index), především u postmenopauzálních žen |
|
Monitorace léčby |
Ovariální karcinom – v kombinaci s HE4 (ROMA index), především u postmenopauzálních žen |
CA 15-3
CA 15-3 je produkován především karcinomy mléčné žlázy. Je používán zejména pro monitorování nemocných s karcinomy prsu. Koncentrace CA 15-3 je zvýšena i u benigních onemocnění prsu, z důvodu poškození jater a ledvin, u zánětů plic, u revmatického onemocnění, rovněž fyziologicky v těhotenství.
Tabulka 7. Referenční hodnoty CA 15-3 v séru
|
|
CA 15-3 (kIU/L) |
|
Normální hodnoty |
0-22 |
|
Hraniční hodnoty |
22-30 |
|
Patologické hodnoty |
> 30 |
Tabulka 8. CA 15-3 a jeho klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Screening |
ne |
|
Diagnostika |
ne |
|
Diferenciální diagnostika |
Karcinom prsu – odlišení benigního nádoru (omezená výpovědní hodnota) |
|
Monitorace onemocnění |
Karcinom prsu (v kombinaci s CEA a eventuálně s dalšími nádorovými markery) |
|
Monitorace léčby |
Karcinom prsu (v kombinaci s dalšími nádorovými markery) - dynamika změn po terapii koreluje s terapeutickým efektem |
CA 19-9
CA 19-9 se u plodu vyskytuje v epitelových buňkách, především trávicího ústrojí, pankreatu a jater. U dospělých je produkován jen ve velice omezené míře epiteliálními buňkami bronchů a trávicího ústrojí. U maligních onemocnění je typický pro adenokarcinomy žaludku, tlustého střeva, pankreatu, jater a vybrané gynekologické nádory. Využívá se především pro monitorování onemocnění.
U 3 – 7 % populace se vyskytuje krevní skupina Lewis a-negativní/b-negativní, které nejsou schopné vytvářet CA 19-9. Na tuto skutečnost musí být brán ohled při interpretaci výsledků.
Falešně pozitivní výsledky jsou nalézány u benigních a zánětlivých onemocnění žaludku, střeva, pankreatu a jater, a u cystické fibrózy.
Tabulka 9. Referenční hodnoty CA 19-9 v séru
|
|
CA 19-9 (kIU/L) |
|
Normální hodnoty |
0-30 |
|
Hraniční hodnoty |
30-40 |
|
Patologické hodnoty |
> 40 |
Tabulka 10. CA 19-9 a jeho klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Screening |
ne |
|
Diagnostika |
ne |
|
Diferenciální diagnostika |
Karcinom jater (doplňkový marker k AFP) |
|
Monitorace onemocnění |
monitorování karcinomu pankreatu (pouze při příznivém průběhu) karcinom jater (doplňkový marker k AFP) |
|
Monitorace léčby |
karcinom pankreatu a žlučových cest |
CA 72-4
CA 72-4 je produkován povrchovými epiteliálními buňkami jícnu, žaludku a pankreatu vyvíjejícího se plodu a ve velmi malém množství u zdravých dospělých. Patologicky je produkován u maligních nádorů žaludku, střeva, pankreatu, mléčné žlázy a některých nádorů ovaria. Sérový marker je užívaný především pro monitorování onemocnění.
Falešně pozitivní výsledky jsou nalézány u benigních postižení jater, ledvin, a zánětlivých onemocnění gastrointestinálního traktu. CA 72-4 má vysokou biologickou variabilitu.
Tabulka 11. Referenční hodnoty CA 72-4 v séru
|
|
CA 19-9 (µg/L) |
|
Normální hodnoty |
0-3 |
|
Hraniční hodnoty |
3-6 |
|
Patologické hodnoty |
> 6 |
Tabulka 12. CA 72-4 a jeho klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Screening |
ne |
|
Diagnostika |
ne |
|
Diferenciální diagnostika |
odlišení benigního a maligního procesu pankreatu vyšetřením tekutiny cyst (v kombinaci s CEA). |
|
Monitorace onemocnění |
Karcinom žaludku (v kombinaci s CEA) Karcinomy jícnu, tlustého střeva, pankreatu Karcinom ovarií (především mucinózního typu) (v kombinaci s CA 125) Karcinom děložního čípku Karcinomy s metastázami do jater |
|
Monitorace léčby |
ne |
CEA (karcioembryonální antigen)
CEA (karcioembryonální antigen) je glykoprotein, který se pravděpodobně účastní procesu buněčné adheze. U plodu je produkován v gastrointestinálním traktu. V dospělém věku je syntetizován v minimálním množství epiteliálními buňkami střevní sliznice, žaludku a bronchů. U maligních onemocnění se CEA se nachází především ve tkáni nádorů karcinomů tlustého střeva a konečníku, u nádorů žaludku, pankreatu, jícnu a žlučových cest. Dále se vyskytuje u karcunomů plic (především adenokarcinomů), karcinomů mléčné žlázy a karcinomů ženským pohlavních orgánů. Karcinom močového měchýře, ledvin, diferencovaný karcinom prostaty a testikulární teratomy patří rovněž k nádorům pozitivním na CEA.
Sérový CEA patří k základním markerům studovaným u různých nádorových lokalizací. Má význam především při stagingu a monitorování onemocnění gastrointestinálního traktu, a to u kolorektálních karcinomů, dále u karcinomů plic, prsu, močového měchýře a dalších malignit.
Falešně pozitivní výsledky se vyskytují u těchto benigních chorob: jaterní cirhózy a onemocnění jater obecně, Crohnovy choroby, střevních polypů, onemocnění plic, ledvin, žlučníku a žlučových cest a pankreatitidy, a také u kuřáků.
Tabulka 13. Referenční hodnoty CEA v séru
|
|
CEA (µg/L) |
|
Normální hodnoty |
0-3 |
|
Hraniční hodnoty |
3-5 |
|
Patologické hodnoty |
> 5 |
Tabulka 14. CEA a jeho klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Screening |
ne |
|
Diagnostika |
ne |
|
Diferenciální diagnostika |
Nemalobuněčný karcinom plic |
|
Monitorace onemocnění |
Karcinomy kolorekta Karcinomy prsu Nemalobuněčný karcinom plic Karcinom štítné žlázy |
|
Monitorace léčby |
Kontrola po operaci kolorektálního a plicního karcinomu Kontrola paliativní terapie karcinomu kolorekta |
hCG (lidský choriogonadotropin
hCG (lidský choriogonadotropin) je glykoprotein, složený z podjednotek α a β, jeho biologickou specificitu podmiňuje především β – podjednotka. Tvoří se v trofoblastických buňkách placenty. U zdravých osob je produkován hypofýzou, jeho fyziologické koncentrace jsou nízké. hCG v séru je zvýšen především u germinativních nádorů (varlata, ovaria) a nádorů trofoblastického původu (choriokarcinom, hydatidózní mola), vzácněji u nádorů pankreatu, plic, močového měchýře, ledvin a GIT. Falešně pozitivní výsledky se nalézají u těhotných žen a u žen s myomy nebo s ovariálními cystami.
V současné době se častěji stanovuje jeho volná podjednotka, freeβ-hCG. Její stanovení však nepřináší oproti stanovení hCG žádnou podstatnou výhodu.
Tabulka 15. Referenční hodnoty hCG v séru
|
|
hCG (kIU/L) |
|
Normální hodnoty |
0-5 |
|
Hraniční hodnoty |
5-10 |
|
Patologické hodnoty |
> 10 |
Tabulka 16. hCG a jeho klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Screening |
pouze monitorování symptomatických osob podobně jako AFP – tj. u osob s podezřením na germinální nádory varlat |
|
Diagnostika |
Choriokarcinom Germinální nádory Mola hydatioza |
|
Diferenciální diagnostika |
Choriokarcinom x mola hydatioza Germinální nádory |
|
Monitorace onemocnění |
Choriokarcinom Germinální nádory |
|
Monitorace léčby |
Choriokarcinom Germinální nádory |
HE4 (human epididymal protein 4)
HE4 (human epididymal protein 4) je glykoprotein, řadí se k proteázám. Je produkován tkání nadvarlat a také epitelem respiračního a reprodukčního traktu. Předpokládá se, že se účastní procesu zrání spermií.Ve vysokých hladinách je detekován v séru pacientek s karcinomem vaječníků, zejména serózního typu, ale i ostatními epitelovými karcinomy včetně adenokarcinomů. Bývá zvýšen také u pacientů s karcinomem plic.
Stanovení HE-4 se používá jako pomůcka při monitorování rekurence nebo progresivního onemocnění pacientů s epiteliálním karcinomem ovarií. Ve spojení s vyšetření CA 125 se používá pro odhad rizika epiteliálního karcinomu ovarií u žen před a po menopauze s tumorem v malé pánvi. Výsledky jsou v tomto případě interpretovány jako ROMA index.
Tabulka 17. HE4 a jeho klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Screening |
ne |
|
Diagnostika |
Omezeně, v kombinaci s CA 125 |
|
Diferenciální diagnostika |
Ovariální karcinom (dif.d. pelvické masy) |
|
Monitorace onemocnění |
Ovariální karcinom (mimo mucinózního typu) |
|
Monitorace léčby |
Ovariální karcinom |
SCCA
SCCA (antigen skvamózních nádorových buněk) je glykoprotein. Je produkován především skvamózními (epidermoidními) buňkami plodu, ve stopových množstvích i u normálních osob. Jeho zvýšená syntéza probíhá v maligních nádorech skvamózního epitelu. Sérový SCCA se využívá především pro monitorování nemocných s epidermoidními nádory plic, cervixu a oblasti hlavy a krku.
Zvýšená exprese SCCA byla prokázána u karcinomu čípku děložního, u dalších maligních gynekologických nádorů, u epidermoidního karcinomu plic a u nádorů hlavy a krku. Falešně pozitivní hladina je nalézána u benigních gynekologických onemocnění, u zánětů plic, poruch ledvin a jater.
Tabulka 18. Referenční hodnoty SCCA v séru
|
|
SCCA (µg/L) |
|
Normální hodnoty |
0-1,5 |
|
Hraniční hodnoty |
1,5-2 |
|
Patologické hodnoty |
> 2 |
Tabulka 19. SCCA a jeho klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Screening |
ne |
|
Diagnostika |
ne |
|
Diferenciální diagnostika |
Nemalobuněčný karcinom plic |
|
Monitorace onemocnění |
Nádory orofaciální oblasti Karcinom plic (především epidermoidní, event. adenokarcinom) Gynekologické nádory ( n.vaginy,vulvy, dělohy, endometria, děložního čípku) |
|
Monitorace léčby |
ne |
Cytokeratinové nádorové markery
Cytokeratinové nádorové markery jsou markery vzniklé narušením nebo nekontrolovaným růstem cytoskeletu buňky. Vyskytují se jako cirkulující fragmenty nebo komplexy fragmentů cytokeratinů 8, 18, 19 normálního epitelu. Uvolňují se do tělních tekutin pravděpodobně během proliferace nádorových buněk či během nekrózy buněk.
CYFRA 21.1 (fragment cytokeratinu 19)
CYFRA 21.1 (fragment cytokeratinu 19) je polypeptid. Předpokládá se, že jeho výskyt v séru nemocných s maligními nádory může souviset s buněčnou nekrosou. Fyziologicky je prokazatelný ve tkáni plic, dělohy a trávicího ústrojí. Je produkován tkáněmi určitých typů maligních nádorů, především nemalobuněčného karcinomu plic, nádorů močového měchýře a nádorů oblasti hlavy a krku.
Je možno nalézt falešně pozitivní hodnoty u nemocných s jaterní cirhózou, s chronickým selháním ledvin, eventuelně s infekcí respiračního traktu.
Tabulka 20. Referenční hodnoty CYFRA 21.1 v séru
|
|
CYFRA 21.1 (µg/L) |
|
Normální hodnoty |
0-2,5 |
|
Hraniční hodnoty |
2,5-3,5 |
|
Patologické hodnoty |
> 3,5 |
Tabulka 21. CYFRA 21.1 a jeho klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Screening |
ne |
|
Diagnostika |
ne |
|
Diferenciální diagnostika |
Karcinom plic |
|
Monitorace onemocnění |
Karcinom dělohy (především děložního čípku) Karcinom močového měchýře Karcinomy hlavy a krku Nemalobuněčný karcinom plic Karcinom prsu |
|
Monitorace léčby |
Nemalobuněčný karcinom plic |
TPA (tkáňový polypeptidový antigen) TPS (tkáňový specifický polypeptidový antigen)
TPA (tkáňový polypeptidový antigen) a TPS (tkáňový specifický polypeptidový antigen) jsou antigeny epiteliálních buněk karcinomů, TPA detekuje fragmenty cytokeratinů 8, 18 a 19, TPS pouze fragmenty cytokeratinů 8 a 18. Byly prokázány ve většině karcinomů, klidová zdravá tkáň je neobsahuje. Jejich výskyt v séru je svázán (na rozdíl od diferenciačních antigenů) spíše s buněčnou aktivitou než s objemem nádorové hmoty.
Sérový TPA, respektive TPS, je univerzální nádorový marker vhodný především pro dlouhodobé sledování nemocných a hodnocení účinnosti terapie, a to u karcinomů plic, prsu, močového měchýře, gastrointestinálního traktu a dalších malignit. TPA či TPS je též potenciálním markerem pro sledování karcinomu ovarií nemucinózního typu (Sturgeon and Diamandis 2010).
Vzhledem k odbourávání játry a vylučování ledvinami je hladina markeru zvýšena u nemaligních postižení těchto orgánů (hepatitida, selhání ledvin atd.) a dále u některých infekčních onemocnění.
Tabulka 22. Referenční hodnoty TPA v séru
|
|
TPA (kIU/L) |
|
Normální hodnoty |
0-120 |
|
Hraniční hodnoty |
120-140 |
|
Patologické hodnoty |
> 140 |
Tabulka 23. Referenční hodnoty TPS v séru
|
|
TPS (kIU/L) |
|
Normální hodnoty |
0-85 |
|
Hraniční hodnoty |
85-95 |
|
Patologické hodnoty |
> 95 |
Tabulka 24. TPA/TPS a jejich klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Screening |
ne |
|
Diagnostika |
ne |
|
Diferenciální diagnostika |
ne |
|
Monitorace onemocnění |
TPA - karcinom prsu (pooperativní sledování) TPS – hepatocelulární karcinom, metastázy do jater |
|
Monitorace léčby |
Karcinom prsu (v případě, že ostatní markery nejsou zvýšené) |
Enzymy
Enzymatické nádorové markery jsou po onkofetálních antigenech druhou nejčastěji užívanou skupinou nádorových markerů. Můžeme je rozdělit na dvě podskupiny:
- enzymy s biologickou funkcí především při buněčném dělení (např. thymidinkináza a neuron-specifická enoláza). Tyto markery jsou značně zvýšené u všech stavů charakterizovaných především výraznou buněčnou proliferací. Proto se uplatňují při určování prognózy a stadia onemocnění.
- enzymy, které se vyskytují i ve zdravých tkáních, kde plní své biologické funkce. Tyto markery jsou vysoce orgánově či tkáňově specifické, ale neposkytují jakoukoliv informaci o typu poškození daného orgánu či tkáně. Dají se použít k určení primární lokalizace nádoru.
Chromogranin A
Chromogranin A je glykoprotein nacházející se v neurokrinních buňkách, ze kterých je též uvolňován. Je prekurzorem různých funkčních peptidů. Neuroendokrinní buňky a žlázy endokrinního systému, které tyto buňky obsahují, mohou způsobit vznik rozličných tumorů, jak benigních, tak maligních. Chromogranin není závislý na biologické aktivitě nádorových buněk, proto slouží jako marker u neuroendokrinních tumorů, které nevykazují sekreční aktivitu nebo produkují látky, které se rutinně nestanovují. Chromogranin je nespecifický nádorový marker, a proto je vhodný zejména při absenci symptomů, kdy nelze zvolit vhodný specifický marker.
Tabulka 25. Chromogranin A a jeho klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Screening |
ne |
|
Diagnostika |
Neuroendokrinní nádory |
|
Diferenciální diagnostika |
Průkaz neuroendokrinní aktivity nádoru |
|
Monitorace onemocnění |
Karcinom plic Neuroendokrinní nádory |
|
Monitorace léčby |
Karcinom plic Neuroendokrinní nádory |
NSE (neuronspecifická enoláza)
NSE (neuronspecifická enoláza) je enzym účastnící se glykolýzy. U plodu lze NSE prokázat v nervové a plicní tkáni, u dospělých hlavně v neuroendokrinních strukturách (především v neuronech). Je produkován rovněž maligními nádory neurálního a neuroendokrinního původu, neuroblastomy, meduloblastomy, dále i seminomy, malobuněčným karcinomem plic a adenokarcinomy ledvin. Sérová NSE se používá pro monitorování nemocných s neuroendokrinními nádory a malobuněčným karcinomem plic.
Falešně pozitivní hladina NSE v séru může být pozorována u nemaligních plicních onemocnění nebo jaterních chorob.
Tabulka 26. Referenční hodnoty NSE v séru
|
|
NSE (µg/L) |
|
Normální hodnoty |
0-10 |
|
Hraniční hodnoty |
10-12,5 |
|
Patologické hodnoty |
> 12,5 |
Tabulka 27. NSE a jeho klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Screening |
ne |
|
Diagnostika |
Neuroendokrinní nádory Malobuněčný karcinom plic |
|
Diferenciální diagnostika |
Neuroendokrinní nádory |
|
Monitorace onemocnění |
Neuroendokrinní nádory Malobuněčný karcinom plic |
|
Monitorace léčby |
Vybrané neuroendokrinní nádory |
|
Prognostický marker |
Neuroblastomy Malobuněčný karcinom plic |
PSA (prostatický specifický antigen)
PSA (prostatický specifický antigen) je serinová proteáza. Je produkován prostatou a je přítomen v prostatické a seminální plazmě, ve zdravé, hyperplastické i maligní prostatické tkáni a v metastázách prostatického původu. V malé míře je produkován i u žen. V séru je přítomen ve 3 hlavních formách:
- volný (freePSA)- 3 formy:
- BPSA – tzv. s benigní hyperplazií asociovaný PSA,
- 2pro-PSA a
- intaktní PSA
- vázaný na α2-makroglobulin
- vázaný na α1-antichymotrypsin.
Koncentrace volné, tj. nekomplexované formy PSA (fPSA) v séru, vztažená ke koncentraci PSA celkového, se liší pro benigní a maligní nádorové onemocnění prostaty. Stanovení fPSA a 2pro-PSA je doplňující vyšetření k celkovému PSA pro hladiny PSA 3,5-10 µg/l. Má význam pouze v časné diagnostice karcinomu prostaty a pro rozlišení mezi benigním a maligním onemocněním prostaty.
Z hodnot markerů se vypočítává % volného PSA; pro maligní onemocnění svědčí hodnota 0-20%. Z hodnot PSA, f-PSA a 2pro-PSA se vypočítává index PHI (Prostate Health Index); při hodnotě 0-40% lze vyloučit maligní etiologii.
Falešně pozitivní hodnoty PSA jsou u benigní hyperplazie a zánětu prostaty.
Tabulka 28. Referenční hodnoty PSA v séru
|
|
PSA (µg/L) |
|
Normální hodnoty |
0-4 |
|
Hraniční hodnoty |
4-10 |
|
Patologické hodnoty |
> 10 |
Tabulka 29. PSA a jeho klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Aktivní vyhledávání familiárních forem |
Karcinom prostaty – muži nad 40 let |
|
Diagnostika |
Časná diagnostika karcinomu prostaty u mužů nad 50 let |
|
Diferenciální diagnostika |
Karcinom prostaty x hypertrofie prostaty |
|
Monitorace onemocnění |
Karcinom prostaty |
|
Monitorace léčby |
Karcinom prostaty |
Thymidinkináza (TK)
Thymidinkináza (TK) je enzym katalyzující přímou fosforylaci thymidinu na thymidinmonofosfát (TMP). Aktivita TK v buňce stoupá v S-fázi buněčného dělení, kdy dochází k syntéze DNA. Aktivita sérové TK odráží míru buněčné proliferace. Za fyziologických podmínek probíhá syntéza TK především v játrech během vývoje plodu, po porodu se syntéza zpomaluje.
Patologicky se nachází v rychle proliferujících tkáních a z těchto tkání se dostává do cirkulace. Intenzivní produkce je pozorována především u onemocnění s generalizovanou zvýšenou proliferací u hematologických malignit. Zvýšená produkce TK je typická rovněž pro některá virová, zánětlivá a revmatická onemocnění.
Tabulka 30. Referenční hodnoty thymidinkinázy v séru
|
|
TK (IU/L) |
|
Normální hodnoty |
0-5 |
|
Hraniční hodnoty |
5-10 |
|
Patologické hodnoty |
> 10 |
Tabulka 31. Thymidinkináza a její klinické využití
|
Fáze klinického rozhodování |
Využití |
|
Screening |
ne |
|
Diagnostika |
Hematoblastomy a lymfomy Leukemie |
|
Diferenciální diagnostika |
ne |
|
Monitorace onemocnění |
Průkaz proliferace u všech maligních onemocnění Hematoblastomy a lymfomy |
|
Monitorace léčby |
Hematoblastomy a lymfomy |
Hormony
Jsou produkovány
- endokrinními buňkami (např. kalcitonin u medulárního karcinomu štítné žlázy nebo tyreoglobulin při typu folikulárním), nebo
- ektopicky, samotným nádorem (např. látka podobná ACTH nebo hCG při bronchogenním karcinomu).
Tyto nádorové markery jsou nečastěji využívány ke kontrole efektu operační či medikamentózní léčby.
Tabulka 19. Hormony a jejich využití jako nádorové markery
|
Nádorový marker |
Typ nádoru |
Fáze vývoje |
|
ACTH (Adrenokortikotropní hormon) |
Nádory plic Neuroendokrinní nádory |
Klinické využití Klinické využití |
|
ADH (Antidiuretický hormon) |
Nádory plic Neuroendokrinní nádory |
Klinické využití Klinické využití |
|
Adiponectin |
Rizikový faktor |
Výzkum |
|
Ghrelin |
Rizikový faktor |
Výzkum |
|
Kalcitonin |
Medulární tyroidální nádory |
Klinické využití |
|
Leptin |
Rizikový faktor |
Výzkum |
|
Parathormon |
Neuroendokrinní nádory |
Klinické využití |
|
Pepsinogen |
Nádory gastrointestinálního traktu |
Omezené klinické využití |
|
Prolaktin |
Nádory plic Neuroendokrinní nádory |
Klinické využití Klinické využití |
|
Resistin |
Rizikový faktor |
Výzkum |
|
Růstový hormon |
Neuroendokrinní nádory |
Klinické využití |
|
Tyreoglobulin |
Tyroidální nádory |
Klinické využití |
Ostatní blíže nespecifikované látky
Nejrůznější tkáněmi produkované blíže nespecifikované látky, které se nedají zařadit do žádné z předchozích skupin, ale při nádorovém bujení se jejich hladiny v krvi zvyšují jako nespecifická reakce organizmu na přítomnost nádorového onemocnění.
- Feritin
- b2-mikroglobulin
- Imunoglobuliny
- Laminin
- Elastin
- Selectin
Nádorové markery spojené s buněčnou proliferací, diferenciací a metastazováním
Dále uvedené markery se zatím až na výjimky klinicky nevyužívají a jsou předmětem výzkumu či evaluace.
Markery spojené se signální transdukcí
- HER-2/neu
- EGF
- IGF-1
- Interleukiny a jejich receptory
- TGF-β
- TNF-α
Angiogenní faktory
- Osteoprotegerin
- osteopontin
- angiostatin
- angiogenin
- bFGF
- endostatin
- VEGF
Adhezívní molekuly
- ICAM-1
- VCAM-1
- E-cadherin
- E-selektin
Markery spojené s apoptózou
- Bcl-2
- sFas
Matrixové metaloproteinázy a jejich inhibitory
Tkáňové nádorové markery
Zatímco sérové nádorové markery se v rutinní praxi používají především pro monitoraci nemocných s již diagnostikovaným nádorem, tkáňové nádorové markery jsou důležité k upřesnění histologického typu nádoru v primární diagnostice a dále jako prognostický a prediktivní faktor. Stanovují se většinou imunohistochemicky v tkáni primárních nádorů.
Příklady:
- Estrogenové (ER) a progesteronové (PR) receptory (karcinom prsu)
- HER-2/neu (karcinom prsu)
- Katepsin D (karcinom prsu)
- uPAI
- p53 (karcinom prsu)
- EGFR (karcinom kolorekta)
Estrogenové a progesteronové receptory
Četné nádory prsu obsahují v buňkách receptory pro estrogeny a/či progesteron, většinou ve velkém množství. Tyto nádory se nazývají hormonálně dependentní (závislé na hormonech), a estrogeny a/či progesteron podporují jejich růst. Zjištění přítomnosti ER a PR pomůže k nasměrování léčby a k určení prognózy. Pacientky s nálezem ER-pozitivních a PR-pozitivních nádorů inklinují k lepší prognóze, než mají pacientky s nálezem ER-negativních a PR-negativních tumorů (ať už se týká celkového přežití nebo přežití bez příznaků nemoci). Tyto pacientky též lépe reagují na endokrinní léčbu (antihormonální léčba, např. tamoxifenem). Status ER a PR představuje prediktivní faktor pro odpověď na hormonální terapii, a to u časných i pokročilých nádorů prsu. V kombinaci s dalšími markery je ho možno využít jako prognostický faktor.
HER-2/neu (c-erbB-2) (Human Epidermal Growth Factor Receptor 2)
HER-2/neu (c-erbB-2) (Human Epidermal Growth Factor Receptor 2) je onkoprotein, patří do rodiny receptorů epidermálního růstového faktoru (EGFR). U 20-25% karcinomů prsu je jeho gen amplifikován a dojde k overexpresi EGFR, což může způsobit větší agresivitu nádoru a rezistenci k hormonální léčbě, a tedy horší prognózu. Na zjištění přítomnosti genu Her2/neu tedy závisí stanovení léčby a prognózy karcinomu prsu. Toto vyšetření se provádí imunohistochemicky nebo metodou FISH. Her-2/neu test je rovněž využíván ke sledování odezvy na terapii, tedy např. hormonální terapii nebo chemoterapii. Ke sledování terapie nádoru jsou někdy rovněž používány hodnoty Her-2/neu v séru. Je-li počáteční hladina vysoká a poté klesá, je to známka, že léčba zabírá; je-li hladina stálá, léčba je nefunkční. Pokud hladina klesá a poté opět stoupá může docházet k recidivě nádoru. Her-2/neu pozitivní tumory jsou vhodné pro léčbu protinádorovým lékem herceptinem ( genericky Tratuzumab) který je cíleně indikován proti Her-2/neu proteinu. Herceptin se váže na nadbytečné molekuly bílkoviny a inhibuje růst nádoru. Exprese HER-2/neu je negativním prognostickým a prediktivním faktorem, zvláště u pacientek s uzlinovými metastázami. HER-2/neu pozitivní karcinomy jsou resistentní k terapii methotrexátem a tamoxifenem, naopak lépe reagují na léčbu doxorubicinem.
Katepsin D
Katepsin D je lysozomální proteináza, dosud nejsou známy její endogenní inhibitory. Nachází se v lysozymech. Biologická funkce této proteinázy, která je ve formě proenzymu secernována rovněž do mléka, je především štěpit proteiny v lysosomech, ale spolupůsobí i při apoptotických a pravděpodobně i nekrotických procesech. Tato proteináza je regulována estrogenem a dalšími růstovými faktory. Je stanovován v tkáni primárního nádoru prsu a jeho zvýšená koncentrace je asociována s vyšším rizikem návratu choroby a metastazování.
EGFR (receptor epidermálního růstového faktoru)
EGFR (receptor epidermálního růstového faktoru) je tyrosinkinázový receptor (označovaný též HER-1). Zvýšená exprese tohoto receptoru byla prokázána u většiny pacientů s metastazujícím karcinomem kolorekta. Je intenzivně studován jako prognostický marker pro karcinom kolorekta, plic a prsu. EGFR též slouží jako cíl pro biologickou léčbu metastazujícího karcinomu kolorekta pomocí inhibitorů EGFR (cetuximab): vazba cetuximabu na EGFR blokuje nitrobuněčnou signalizaci EGFR a vede na buněčné úrovni k inhibici tvorby metastáz.
Zjistilo se, že u anti-EGFR protilátek hraje zásadní roli mutace genu K-ras, proto se nověji vyšetřuje tato mutace jako prediktivní marker. Zároveň je K-ras status nezávislým prognostickým faktorem asociovaným s mediánem přežití a dobou do progrese.
Tumor supresorový gen p53 je je klíčovým regulačním faktorem, který monitoruje poškození DNA. Inaktivace p53 bývá jedním z prvních kroků, který vede k maligní transformaci při vývoji řady nádorových onemocnění. Mutace genu p53 může být užitečným prognostickým markerem u pacientek s karcinomem prsu bez uzlinových metastáz (jeho overexprese je spojena s horší prognozou karcinomu prsu), avšak zatím není rutinně klinicky využíván.
Markery stanovované metodami molekulární biologie
Tyto markery se využívají především jako prognostické (k odhadu rizika vzniku nádorového onemocnění) a jako prediktivní markery.
Příklady:
- BRCA1, BRCA2 – karcinom prsu
- k-ras
- testy MammaPrint, Oncogen
Cirkulující nádorové buňky (CTC)
Největší diagnostický potenciál má analýza samotných nádorových buněk. Tak je tomu u leukemických onemocnění, kdy se leukemické buňky nacházejí přímo v periferní krvi. U solidních nádorů se nádorové buňky mohou do krevní cirkulace dostávat cestou lymfogenního nebo hematogenního metastazování.
U pacientů se solidními nádory epiteliálního původu jak s lokalizovanými nádory, tak s metastatickým postižením, se v periferní krvi mohou nacházet cirkulující buňky nádorové buňky. K určení, zda se jedná o cirkulací nádorovou buňku, je nutný průkaz přítomnosti vybraných nádorových markerů (výběr souvisí s typem nádoru), ale kromě toho je nezbytné ověřit i morfologii buňky. Vzhledem k této poměrně složité metodice, a protože se nepotvrdil předpoklad, že počet CTC je ve vztahu k prognóze nádorového onemocnění, není stanovení cirkulujících buněk používáno v rutinní praxi a je předmětem výzkumu.
Sentinelová uzlina z operačního materiálu podává informaci o infiltraci regionálních lymfatických uzlin nádorovými buňkami, a je využívána pro rozhodnutí o radikálnosti chirurgického zákroku. V minulosti se vyšetření sentinelové uzliny provádělo především u nádorů prsu a ovarií, v současné době se provádí prakticky u všech nádorů.
Shrnutí
- Solubilní (sérové) nádorové markery jsou vhodné zejména pro follow up nádoru, tj včasný záchyt progrese nebo recidivy nádoru, eventuelně pro monitoraci léčby. Jako prognostické a prediktivní markery se v současné době využívají zejména markery stanovované imunohistochemicky nebo metodami molekulární biologie v tkáních.
- Orgánová specificita při vyšetřování jednoho izolovaného markeru je relativně nízká, proto je nutné vyšetřovat nádorové markery v pravidelných intervalech a v optimální kombinaci.
- Mnohdy je opomíjeno předoperační stanovení nádorových markerů, které je nezbytným předpokladem využití markerů v úspěšné kontrole terapie.
- Normální hodnota nádorového markeru nevylučuje přítomnost nádorového onemocnění (existují i generalizované karcinomy s normálními hodnotami.
- Perspektivy jsou ve vyhledávání nových markerů pomocí nejmodernějších analytických metod (proteomiky, genomiky a dalších) a při volbě terapie využívání znalostí personalizované medicíny. Pro kontrolu léčby - použití cíleného markeru pro cílenou léčbu (např. VEGF pro antiangiogenní léčbu), pro diagnostiku mikrometastáz - stanovení cirkulujících nádorových buněk v periferní krvi.
Doporučená literatura
- ASCO - American Society of Clinical Oncology: Clinical Practice Guidelines for the Use of Tumor Markers in Breast and Colorectal Cancer. J Clin Oncology, 1996, 14(10), p. 2843-2877.
- ASCO special article: 2000 Uptade of Recommendations for the Use of Tumor Markers in Breast and Colorectal Cancer. Clinical practice guidelines of the American society of clinical oncology.
- Duffy MJ, van Dalen A, Haglund C, Hansson L, Klapdor R, Lamerz R, Nilsson O, Sturgeon C, Topolcan O. Clinical utility of biochemical markers in colorectal cancer: European Group on Tumour Markers (EGTM) guidelinesEur J Cancer. 2003 Apr;39(6):718-27. Review.
- Duffy MJ, van Rossum LG, van Turenhout ST, Malminiemi O, Sturgeon C, Lamerz R,Nicolini A, Haglund C, Holubec L, Fraser CG, Halloran SP: Use of faecal markers in screening for colorectal neoplasia: a European group on tumor markers position paper. Int J Cancer 2011; 128: 3–11.
- Duffy MJ. Evidence for the clinical use of tumour markers Ann Clin Biochem. 2004 Sep;41(Pt 5):370-7.
- Duffy MJ., McGing P. Guidelines for the Use of Tumour Markers. 2005. (ke stažení na odkazu http://acbroi.org.uk/science/documents/tumourmarkerbooklet3rdedn2005_001.pdf)
- Duffy MJ: Tumor Markers in Clinical Practice: A Review Focusing on Common Solid Cancers. Med Princ Pract 2013;22:4–11
- EGTM. Tumour Markers in Gastrointestinal Cancers-EGTM Recommendations. Anticancer Research 1999,19, p. 2785-2820.
- Harris, L., Fritsche, H., Mennel, R., Norton, L., Ravdin, P., Taube, S.,Somerfield, M.R., Hayes, D.F., Bast Jr., R.C., 2007. American Society of Clinical Oncology 2007 update of recommendations for the use of tumor markers in breast cancer. J. Clin. Oncol. 25, 5287e5312
- Holubec, L., Jr., Topolčan, O., Pikner, R.: Biologická aktivita u kolorektálního karcinomu. Čas. Lék. Čes. 2002, 141(16), s. 508-512
- Holubec, L.jr, Topolčan, O., Fínek, J., Pikner, R., Pecen, L., Lipská, L., Holubec, L.sen., Visokai, V. The role of VCAM, ICAM, Selectin E and Selectin P in detection of liver metastases of colorectal carcinoma. Tumor Biology 23(S1): 51, 2002
- Kaušitz, J. et al.: Onkológia. Veda, 2003.
- Klečka J., Holubec L., Pešta M., Hora M., Topolčan O., Eret V. Nádorové markery karcinomu prostaty. Ces Urol 2008; 12(3), pp 173–185.
- Kučera R., Topolčan O., Presl J.,et al. Klinický přínos ROMA indexu při diagnostice ovariálního karcinomu. Klin. Biochem. Metab., 20 (41), 2012, No. 4, p. 248–251.
- Locker, G.Y., Hamilton, S., Harris, J., Jessup, J.M., Kemeny, N., Macdonald, J.S., Somerfield, M.R., Hayes, D.F., Bast Jr., R.C., 2006. ASCO 2006 update of recommendations for the use of tumor markers in gastrointestinal cancer. J. Clin. Oncol. 24, 5313e5327
- Masopust J. et al.: Patobiochemie buňky. 2003. ISBN: 80-239-1011-0.
- Nekulová M., Pecen L., Topolčan O., Šimíčková M., Valík D. Nádory pankreatu a indikace vyšetření nádorových markerů. (ke stažení na odkazu http://www.roche-diagnostics.cz/download/la/odborne/pankreas.pdf.
- Nelson, AR., Fingleton, B., Rothenberg, LM., Matrisian, LM. Matrix Metalloproteases: Biologic Activity and Clinical Implications. J Clin Oncology 2000, 18(5), p. 1135-1149.
- Stevenson, SGW. Matrix metalloproteinases in angiogenesis: a moving target for therapeutic intervention. J of Clin Investig 1999, 103, p. 1237-1241
- Sturgeon C, Diamandis E. Use of Tumor Markers in Testicular, Prostate, Colorectal, Breast and Ovarian Cancers. NACB Laboratory Practice Guidelines, 2010, 84 pp.
- Topolčan O., Holubec L. jr., Fínek J., Pikner R. Využití nádorových markerů pro prognózu karcinomu prsu. Vybrané otázky z onkologie VI. Galén 2002, p. 19-123. ISBN 80-7262-196-3.
- Valík D., Zima T., Topolčan O.: Doporučení České společnosti klinické biochemie (ČSKB ČLS JEP), České onkologické společnosti (ČOS ČLS JEP), České společnosti nukleární medicíny (ČSNM ČLS JEP) -sekce imunoanalytických metod k využití nádorových markerů v klinické praxi. (ke stažení na odkazu http://www.cskb.cz/res/file/doporuceni/TM/TM_dopor.pdf)