Principy imunoanalytických metod
| Stránky: | POSTUDIUM |
| Kurz: | Principy imunoanalytických metod |
| Kniha: | Principy imunoanalytických metod |
| Vytiskl(a): | Nepřihlášený host |
| Datum: | středa, 18. února 2026, 21.29 |
Popis
Autoři: Kristián Šafarčík, Vladimír Bartoš, Marie Karlíková
Obsah
- ZÁKLADNÍ POJMY A PRINCIPY IMUNOANALÝZY
- Reakce protilátka-antigen
- Protilátky
- Antigen
- Charakteristika imunoanalytických metod
- ANALYTICKÉ A KLINICKÉ PARAMETRY
- Citlivost stanovení
- Správnost a bias
- Přesnost a nepřesnost
- Nejistota měření
- Referenční meze
- Biologická variabilita
- Klinická senzitivita a specificita
- Efektivita testu
- Prediktivní hodnoty
- ROC křivka
- NÁVAZNOST MĚŘENÍ
- Standardizace imunoanalytických metod
- IMUNOANALYTICKÉ METODY A TECHNOLOGIE
- Neizotopové metody
- Multiplexové metody
ZÁKLADNÍ POJMY A PRINCIPY IMUNOANALÝZY
Autoři: Kristián Šafarčík, Vladimír Bartoš, Marie Karlíková
Využití imunochemické reakce protilátka-antigen in vitro je základem metod klinické diagnostiky i výzkumu, které slouží ke kvantifikaci molekul v biologických tekutinách, extraktech tkání či supernatantech buněčných kultur. Mimořádně vysoká citlivost imunoanalytických metod (detekční limity dosahují hodnot 10-25 až 10-20 mol.L-1, což v praxi znamená koncentraci přibližně jedné molekuly na litr) souvisí s přirozenou reaktivitou protilátek, zejména s jejich vlastnostmi:
1/ schopností vázat se na široké množství přirozených i umělých sloučenin, buněk i virů, které se chovají jako antigeny (protilátky jsou proteinového charakteru a jejich velké množství vazebných míst je odvozeno z obrovského počtu kombinací sekvencí aminokyselin),
2/ specifitou pro reagující látku, tj. schopnost vázat se právě na tuto látku za přítomnosti dalších sloučenin,
3/ silou vazby protilátky s antigenem, takže komplex protilátky-antigen zůstane stabilní i během různých, např. separačních procesů.
Pro detekci a kvantitativní vyjádření výsledku je nezbytné, aby jeden z účastníků reakce (buď protilátka, nebo antigen) byl značený indikátorem, který lze jednoduše měřit s vysokou přesností a reprodukovatelností. Indikátorem může být radioaktivní izotop (radioizotopové metody) nebo jiná látka: enzym, fluorescenční látka, DNA, koloidní částice a pod. (neradioizotopové metody). Více viz kapitola Indikátory u imunoanalytických metod.
Moderní imunoanalytické metody jsou snadno proveditelné a dobře automatizovatelné. Uplatňují se v mnoha odvětvích lékařství i biomedicínského výzkumu. Využívají se zejména ke stanovení látek s velmi nízkou koncentrací, např. hormonů, nádorových markerů, cytokinů apod., ale i imunoglobulinů, virů, léků a mnoha dalších molekul.
Počátky imunoanalýzy
V 50. letech 20. století fyzikové Rosalyn Yalowová a Solomon Berson (pracovní i životní partneři) popsali princip radioimunoanalýzy (RIA), s jejíž pomocí změřili do té doby nedetekovatelná množství inzulinu v krvi. Yalowové a Bersonovi bylo jasné, že obdobné metody, založené na soutěži značeného a neznačeného antigenu o vazebná místa, bude možné vypracovat i pro další analyty, a tuto možnost chtěli poskytnout celému světu. Proto své poznatky uveřejnili bez patentové ochrany. V roce 1977 obdržela Yalowová (Berson se toho již nedožil) Nobelovu cenu za vývoj radioimunoanalýzy pro peptidové hormony. Později se hledaly i jiné možnosti značení molekul tak, aby byla umožněna stejně citlivá detekce. V roce 1971 se objevily metody, které místo radioizotopů využívaly enzymy. Jejich autory byli Eva Engvallová s Peterem Perlmanem ze Švédska a Bauke van Veemen s Antonem Schuursem z Holandska. Zatímco Holanďané svůj systém patentovali, Engvallová a Perlman věnovali světu metodu ELISA (Enzyme Linked Immunosorbent Assay) stejně velkoryse, jako to před nimi s RIA udělali R. Yalowová a S. Berson. (převzato z Lapčík 2009).
Reakce protilátka-antigen
K reakci protilátka-antigen in vivo dochází při imunitní odpovědi organizmu. Reakce
in vitro je využívána v imunoanalytických laboratorních stanoveních.
Při reakci antigen-protilátka vzniká protilátkově-antigenní komplex (imunokomplex).
![]()
Ab = protilátka, Ag = antigen, AbAg = imunokomplex
Reakce je reverzibilní. Vazba v imunokomplexu je nekovalentní, závisí na několika druzích slabých sil, jako jsou hydrofobní vazby, vodíkové můstky, van der Waalsovy síly a interakce iontů. O pevnosti vazby rozhoduje rovnovážná konstanta; obecně je vazba protilátka-antigen silná, což je důležité při separačních a dalších procesech.
Reakce je specifická, tj. protilátka je schopná specificky vázat určitý antigen i za přítomnosti dalších sloučenin v mnohonásobně vyšší koncentraci.
Obecně lze imunoanalytické metody zařadit mezi analytické postupy založené
na specifické reakci ligandu (L) a vhodného vazebného reagens (VR) za vzniku komplexu (L-VR).
![]()
Odtud plyne nejobecnější označení těchto metod jako metody "ligandové analýzy".
Protilátky
Protilátky (angl. antibody, Ab) jsou proteiny produkované vyššími živočichy jako součást imunitní odpovědi. Protilátky patří mezi glykoproteiny, které nazýváme imunoglobuliny. V imunoanalýze jsou nejdůležitější komponentou reakce.
Ke stanovení žádané molekuly (analytu) se využívá jedna nebo několik různých protilátek. Analytem může být látka, která je přirozenou součástí organismu
(např. hormony štítné žlázy) nebo je v těle produkována, ale typicky přítomna není (např. tumorové markery), nebo látky, které se v těle přirozeně nevyskytují
(léky, drogy apod.).
Specifitu protilátky pro určitou antigenní determinantu, tj. schopnost vázat
se pouze na toto místo určitého antigenu, určují sekvence aminokyselin na lehkých řetězcích molekuly protilátky (obr. 1). Tyto sekvence zároveň vytvářejí vazebné místo pro antigenní determinantu – paratop. Systém paratop-antigenní determinanta (nazývaná též epitop) se podobá schématu zámek-klíč (obr. 2).
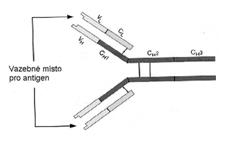
Obrázek 1 Schematická struktura imunoglobulinu
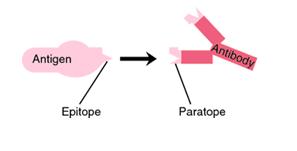
Obrázek 2 Paratop protilátky a epitop antigenu (zdroj: medical-dictionary.thefreedictionary.com)
Chemická struktura protilátek
V živém organismu se vyskytuje několik typů protilátek, které řadíme do tříd imunoglobulinů IgG, IgM, IgA, IgD nebo IgE. Všechny třídy imunoglobulinů mají podobnou strukturu, skládají se dvou lehkých řetězců (L) a dvou těžkých řetězců (H). Lehké řetězce jsou vázány disulfidovými vazbami k těžkým řetězcům, které jsou mezi sebou rovněž vázány disulfidovými vazbami. Lehký řetězec má relativní molekulovou hmotnost asi 22500 a obvykle se skládá z 220 aminokyselin, těžký řetězec má relativní molekulovou hmotnost okolo 50000 a je většinou tvořen 450 aminokyselinami. Lehké i těžké řetězce mají variabilní (VL) a konstantní (CL) část. Variabilní části jsou tvořeny vždy 100 až 110 aminokyselinovými zbytky na N-konci řetězců.
Specifita protilátky závisí i na interferenci s jinými látkami, než je látka, pro jejíž stanovení je protilátka určena. Mírou specifity protilátky je procento zkřížené reakce s interferující látkou.
Dalšími důležitými charakteristikami protilátek jsou:
- afinita
- avidita
Afinita je energie vazby protilátky s jednou antigenní determinantou. Je vyjádřena pomocí asociační konstanty (Kas) reakce. Kvalitní protilátky používané pro účely imunoanalýzy by měly mít Kas = 1010 - 1012 L.mol-1.
Většina antigenů je však multivalentních, tj. má několik vazebných determinant pro různé protilátky. Energie vazby mezi celou molekulou antigenu a protilátkou vyjadřuje avidita. Avidita je závislá na afinitě, ale bere v úvahu valenci antigenu a protilátky i nespecifické faktory, které ovlivňují vazby mezi antigenem a protilátkou. Valence protilátky je počet vazebných míst na její molekule, která jsou schopna reagovat s determinantami určitého antigenu; podobně valence antigenu je počet determinantních skupin, které se mohou vázat s protilátkou. Protilátky tedy jsou buď monovalentní (obsahují jedno vazebné místo), nebo polyvalentní (obsahují více vazebných míst).
Podle způsobu přípravy a charakteru dělíme protilátky do dvou základních skupin, na:
- protilátky polyklonální,
- protilátky monoklonální.
Polyklonální protilátky
Připravují se cílenou imunizací zvířat. Je to proces, kdy se vybranému zvířeti aplikuje příslušný antigen v emulzi s tzv. “Freundovým adjuvans” (směs minerálních olejů, vosků a neživých bakterií, která zvyšuje imunitní reakci na podaný antigen). Doba imunizace, která je potřebná k tvorbě protilátek, je pro jednotlivé antigeny různá (2 až 6 měsíců). Během této imunizace vzniká v krevním séru zvířete směs protilátek proti různým antigenním determinantám použitého antigenu.
Pokud byl k imunizaci použit jeden antigen (např. jedna bílkovina), vytvářejí se monospecifické protilátky. Imunizace zvířat směsí antigenů navozuje produkci polyspecifických protilátek, obsahující imunoglobuliny proti většímu počtu antigenů.
Polyklonální protilátka může reagovat s několika antigenními determinantami. Příprava polyklonálních protilátek je nereprodukovatelný proces, takže opakováním nelze připravit identické protilátky.
Monoklonální protilátky
Monoklonální protilátky nejsou produkovány přímo organismem, ale buněčnou kulturou (Obrázek 3). Způsob přípravy těchto protilátek byl roku 1975 publikován G. Köhlerem a C. Milsteinem, kteří v roce 1984 spolu s N. K. Jernem získali Nobelovu cenu za fyziologii a medicínu, a to za „ teorie pojednávají o specificitě ve vývoji a kontrole imunitního systému a za objev principu produkce monoklonálních protilátek“.
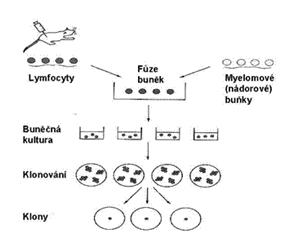
Obrázek 3. Příprava monoklonálních protilátek. (Zdroj: Zichová et al. 1993)
Prvním krokem procesu je imunizace myši příslušným antigenem a následně se z její sleziny získají lymfocyty produkující protilátky. Druhým krokem je jejich hybridizace s myelomovými (nádorovými) buňkami, kdy dojde k fúzi obou typů buněk (tj. ke splynutí jader myelomové buňky a lymfocytu) a vytvoření tzv. hybridomů. Syntéza protilátky pokračuje v hybridomu, což je dáno geny imunizovaného zvířete (“lymfoidního rodiče”). Po “myelomovém rodiči” získá hybridom “nesmrtelnost”, může se množit bez omezení po mnoho generací. Vhodnou selekcí hybridomů (tzv. klonováním), lze pak vybrat ty klony, které produkují protilátky proti vybrané antigenní determinantě antigenu. Protilátka syntetizovaná hybridomem je homogenní, s jediným typem vazebného místa, je produktem jednoho klonu lymfocytů. Hybridomy lze uchovávat za určitých podmínek (např. zmrazením na nízkou teplotu) a použít pro další produkci protilátek.
Monoklonální protilátka tedy rozeznává jedinou antigenní determinantu, její příprava je, na rozdíl od polyklonálních protilátek reprodukovatelná.
Monoklonální protilátky (zpravidla myší) jsou využívány i v diagnostice a léčbě rakoviny. Mohou však u pacientů vyvolat imunitní odpověď - produkci anti-myších neboli protilátek HAMA (Human-Anti-Mouse-Antibodies), která vede k falešně pozitivním, případně falešně negativním výsledkům u imunoanalytických stanovení.
Jaký typ protilátek pro imunoanalýzu?
Shrnutí nejdůležitějších vlastností polyklonálních a monoklonálních protilátek s ohledem na jejich využití v imunoanalýze je uvedeno v Tabulce 1.
Tabulka 1. Srovnání vlastností polyklonálních a monoklonálních protilátek
|
|
Polyklonální protilátky |
Monoklonální protilátky |
|
Specifita |
++ |
+++ |
|
Afinita |
+++ |
++ |
|
Avidita |
+++ |
++ |
|
Reprodukovatelnost přípravy |
ne |
ano |
|
Množství připravené protilátky |
omezené |
neomezené |
|
(Počáteční) náklady na přípravu |
nízké |
vysoké |
|
Počet epitopů, které rozeznávají |
2 a více |
1 |
|
Zkřížené reakce |
ano |
ne |
|
Možnost interference HAMA |
ne |
ano |
|
Reprodukovatelnost výsledků |
++ |
+++ |
|
Citlivost |
+++ |
++ |
+++ = velmi dobrý, ++ = dobrý
Nelze jednoznačně říci, který typ protilátek je pro imunoanalýzu vhodnější; záleží nna konkrétním uspořádání analýzy. V současné době se v klinické diagnostice převážně používají monoklonální protilátky.
Antigen
Antigeny jsou makromolekulární látky přirozeného nebo syntetického původu, které imunitní systém rozeznává jako cizí. Jejich přítomnost v organismu stimuluje tvorbu protilátek, resp. navozuje imunitní odpověď.
Vzhledem ke své reakci může být antigen
- kompletní – imunogen (např. růstový hormon, inzulin), nebo
- nekompletní – hapten (např. steroidní hormony), z něhož pomocí vazby s makromolekulárním nosičem vznikne imunogen.
Imunogen je charakterizován dvěma vlastnostmi. Jsou to:
- imunogenicita, neboli schopnost navodit imunitní odpověď (tvorba protilátek, zapojení regulačních a výkonných lymfocytů), a
- specifita, tj. schopnost s těmito lymfocyty a protilátkami reagovat. Imunogen reaguje jen s těmi lymfocyty a protilátkami, jejichž tvorbu vyvolal.
Každý imunogen se skládá z makromolekulárního nosiče a nízkomolekulárních determinantních skupin, tzv. antigenních determinant neboli epitopů. Antigenní determinanta je tvořena 5-8 aminokyselinami nebo monosacharidovými jednotkami, které se strukturálně nacházejí blízko u sebe. Různé antigeny obsahují různé antigenní determinanty a změna jedné aminokyseliny nebo monosacharidu dává vznik protilátce se zcela odlišnými vlastnostmi. Schopnost protilátek rozlišovat i malé rozdíly epitopů je základem specifity imunitních reakcí.
Imunogen musí splňovat určité fyzikální, chemické a biologické vlastnosti.
Z fyzikálních vlastností je to zejména
- relativní molekulová hmotnost > 10 000,
- rozpustnost
- elektrický náboj.
- tvar molekuly (konformační struktura)
- dostupnost epitopů.
Z chemického hlediska mohou být imunogeny prakticky všechny biopolymery nacházející se v živých systémech stejně jako řada syntetických antigenů. K nejsilnějším imunogenům se řadí proteiny, následují polysacharidy. Čisté lipidy tvoří často pouze hapteny, jejich imunogenicita stoupá vazbou s proteiny nebo polysacharidy.
Z biologických vlastností je třeba zmínit především genetickou vzdálenost. Čím větší bude rozdíl mezi zdrojem antigenu a příjemcem, tím větší bude jeho imunogenicita.
Míra imunitní odpovědi na podaný antigen závisí na dávce a způsobu podání. Stejné množství antigenu, které je neúčinné při intravenózním podání, může vyvolat výraznou odpověď, je-li podáno subkutánně. Vzrůstající dávky vedou k vyšší imunitní odpovědi, nejsou však přímo úměrné zvýšené dávce imunogenu. Vzrůstající dávky mohou za určitých okolností stimulaci tvorby protilátek nejen snížit, ale mohou vyvolat i specifickou neodpovídavost nebo dokonce toleranci vůči danému imunogenu.
Charakteristika imunoanalytických metod
Předností imunoanalytických metod je jejich vysoká citlivost a přesnost, dovolující v různých biologických materiálech běžně stanovovat látky obsažené v koncentracích řádově 10-9 mol.l-1 až 10-15 mol.l-1 a to většinou bez předchozí úpravy vzorků
Existuje několik možností a kritérií, podle nichž lze imunoanalytické metody dělit a charakterizovat:
a) podle základního metodického principu – kompetitivní a nekompetitivní metody,
b) podle nutnosti separace volné a vázané frakce indikátoru – heterogenní a homogenní metody,
c) podle druhu použitého indikátoru.
Kompetitivní metody
V případě kompetitivních metod je specifická protilátka (Ab) v reakci přítomna v omezeném množství. O její vazebná místa soutěží (kompetují) značený antigen (Ag*) v nadbytku a stejný, avšak neznačený antigen (Ag), který je přítomen v analyzovaném vzorku a jehož množství stanovujeme. Dochází k saturaci vazebných míst protilátky oběma antigeny:
Ag + Ag* + Ab ![]() Ag-Ab + Ag* Ab + Ag + Ag*
Ag-Ab + Ag* Ab + Ag + Ag*
Graficky je kompetitivní imunoanalýza znázorněna na Obrázku 4.

Obrázek 4. Princip kompetitivní radioimunoanalýzy (převzato z www.zdn.cz).
Při praktickém provádění této metody se do všech reakčních zkumavek pipetují konstantní množství protilátky a značeného antigenu; množství antigenu je vždy větší než množství protilátky. Množství protilátky je proto nedostačující k navázání všech přítomných molekul antigenů. Výsledkem reakce je vznik dvou imunokomplexů, neznačeného (Ag-Ab) a značeného (Ag*-Ab). V reakční směsi zůstávají i antigeny nenavázané (Ag*, Ag), tj.volné. V rovnovážném stavu reakční směsi je množství vznikajícího značeného komplexu (Ag*-Ab) nepřímo úměrné množství přítomného neznačeného antigenu (Ag). Podíl značeného antigenu (indikátoru), vázaného na protilátku (množství značeného komplexu Ag*-Ab), se obvykle označuje jako vázaná frakce (B - “bound”). Jako volná frakce (F - “free”) se označuje množství nevázaného indikátoru Ag*. Pro kvantitativní vyhodnocení je nutná vzájemná separace obou frakcí, která se provádí různými fyzikálně-chemickými postupy. Po jejich oddělení je nutné změřit odezvu alespoň jedné z frakcí. Podle druhu použitého indikátoru je měřenou odezvou radioaktivita, absorbance, fluorescence, luminiscence apod.
Na základě analýzy kalibrátorů lze pak znázornit grafickou závislost měřené odezvy (např. poměrů B/F - osa y) na koncentraci antigenu (osa x) a tak sestrojit kalibrační závislost (Obrázek 5). V případě kompetitivních metod získáme v lineárních souřadnicích křivku ve tvaru hyperboly. Jestliže se za stejných podmínek jako kalibrátory analyzuje vzorek s neznámým obsahem antigenu, pak lze určit z kalibrační závislosti jeho koncentraci.
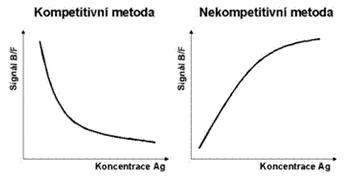
Obrázek 5 Charakteristické kalibrační závislosti u kompetitivních a nekompetitivních metod
Kompetitivní metody jsou základem nejstarší imunoanalytické metody, radioimunoanalýzy (RIA).
Nekompetitivní metody
Specifická protilátka (Ab) je v reakci přítomna v nadbytku. S ní reaguje stanovovaný antigen (Ag) a pro kvantifikaci slouží vhodně označená specifická protilátka (Ab*). Průběh lze opět zjednodušeně popsat vztahem:
Ag + Ab* ![]() Ag-Ab* + Ab*
Ag-Ab* + Ab*
Množství komplexu [Ag-Ab*] je tentokrát přímo úměrné množství stanoveného antigenu (viz Obrázek 5). Kalibrační závislost má stoupající charakter, který je v určitém rozsahu koncentrací více či méně lineární.
V praxi však není obvykle používán výše popsaný jednoduchý princip reakce. Jeho nejužívanější modifikací je tzv. "two-site" imunometrická analýza (Obrázek 6), kdy vedle do reakce vstupují jako vazebné reagencie dvě specifické protilátky, obě jsou přítomné v nadbytku. Každá z nich je namířena proti jiné antigenní determinantě stanovovaného antigenu. Neznačená protilátka (vychytávací – „capture“) bývá zakotvena na stěnu reakční zkumavky nebo na jinou pevnou fázi (partikule, kuličky) a slouží k vychytání a připevnění komplexu antigen-značená protilátka na tuto pevnou fázi, čímž podstatným způsobem usnadňuje separační krok metody. Druhá protilátka slouží jako indikátor průběhu reakce (signální protilátka).
Schematicky je možno princip metody popsat pomocí vztahu:
Ab1 + Ag + Ab2* ![]() Ab1-Ag-Ab2* + Ab1 + Ab2*
Ab1-Ag-Ab2* + Ab1 + Ab2*
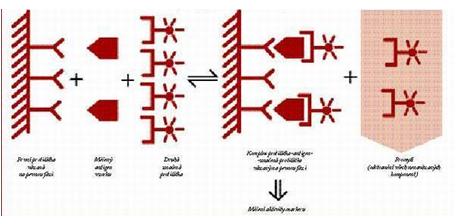
Obrázek 6. Princip nekompetitivní imunoanalýzy (zdroj: www.zdn.cz).
I v tomto případě je množství indikátoru konstantní (tentokrát jím však je značená protilátka), a proměnlivé je množství stanovovaného antigenu (ve vzorcích nebo kalibrátorech). Obvykle se měří množství vzniklého značeného komplexu [Ab1-Ag-Ab2*], které, je přímo úměrné množství určovaného antigenu. Nezreagovaná (přebytečná) signální protilátka je po ukončení reakce odstraněna ze systému.
Nekompetitivní imunoanalytické metody jsou často označovány také jako metody imunometrické. V případě těchto metod našly velké uplatnění monoklonální protilátky.
Heterogenní a homogenní metody
Z principu imunoanalytických metod vyplývá, že je pro stanovení sledovaného analytu je potřeba oddělit vzniklý komplex protilátka - antigen od ostatních substancí; v některých případech to však nutné není. Na základě toho dělíme metody na heterogenní a homogenní.
Heterogenní metody vyžadují separaci volné a vázané frakce indikátoru.
K separaci byla a je používána řada principů a tím i různých činidel, od původně nespecifických metod používaných v počátcích imunoanalýzy (spolusrážení polyethylenglykolem nebo adsorpce na povrchu aktivního uhlí) přes specifičtější metody druhé protilátky (např. prasečí protilátka proti králičím imunoglobulinům) až k současně nejužívanějším technikám, které využívají různé typy pevných fází (stěny zkumavek nebo reakčních jamek, mikročástice, různé partikule apod.).
Každá separační technika má své výhody a nevýhody. Při jejím výběru je nutno přihlížet k vlastnostem jednotlivých komponent přítomných v reakční směsi i k charakteru imunochemické reakce.
Obecně lze shrnout, že všechny využívané separační techniky by měly splňovat několik základních požadavků:
- kvantitativní oddělení obou frakcí tak, aby jedna (případně obě) mohly být měřeny,
- stejná účinnost pro kalibrátory i analyzované vzorky,
- dobrá opakovatelnost (tj. přesnost v jednom stanovení) i reprodukovatelnost (mezi jednotlivými analýzami),
- rychlost, jednoduchost, automatizovatelnost.
U homogenních metod je zdrojem signálu, jehož detekcí stanovujeme koncentraci sledovaného analytu, imunochemická reakce; není zde proto nutná separace volné a vázané frakce indikátoru. Příkladem je homogenní enzymováá imunoanalýza (viz kapitola Enzymová imunoanalýza).
Indikátory u imunoanalytických metod
Obecně se jedná o antigeny nebo protilátky, které jsou vhodným způsobem označeny a tak umožňují kvantifikaci výsledku imunoanalytické reakce. Tyto látky jsou schopny buď samy o sobě produkovat detekovatelný signál, nebo jeho produkci zprostředkovaně vyvolat. Imunoreaktivita značené látky musí být identická s imunoreaktivitou látky neznačené.
Indikátory lze rozdělit do dvou skupin, na radioaktivní a neradioaktivní.
Jako první indikátory byly v imunoanalýze používány substance značené vhodným radionuklidem. Nejčastějším radionuklidem využívaným k přípravě indikátorů pro účely radioimunoanalýzy je 125I. Vedle něj se v praxi využívají i jiné radionuklidy, například 3H, 12C nebo 57Co. Obecným požadavkem na radioindikátor je, aby byl radiochemicky čistý, tedy aby obsahoval radionuklid vázaný pouze v jedné chemické formě.
Později (ve snaze o získání stabilnějších indikátorů s vyšší specifickou aktivitou) byly ke značení využívány i neradioaktivní značky. Místo radionuklidů jsou používány především:
- enzymy
- látky, které přímo vykazují fluorescenci nebo luminiscenci
- enzymy, které katalyzují vznik takovýchto látek
- latexové částice
- molekuly, které tvoří volné radikály
- viry (bakteriofágy).
Tyto značky (enzymy, fluorofory, luminofory a další) se však podstatně liší svou velikostí a tím i možným vlivem na imunoreaktivitu značeného indikátoru (Obrázek 7).
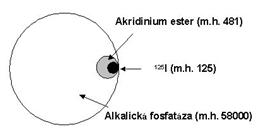
Obrázek 7. Relativní velikosti látek k přípravě indikátorů
Podle typu neradioaktivního indikátoru je volen optimální způsob detekce. Místo měření radioaktivity se tak užívá principů:
- kolorimetrie - měření absorpce světla roztokem zbarveným po proběhlé enzymatické reakci
- fluorometrie - měření fluorescence indikátorů nebo vzniklého produktu enzymatické reakce
- luminometrie - měření produkce světelných kvant luminiscenční reakce
- nefelometrie - měření rozptylu světelného záření na povrchu částic
- turbidimetrie - měření zeslabení světelného záření vlivem zákalu roztoku
- počítání částic - počítání částic určité velikosti poté, co proběhla imunochemická reakce.
V kapitole Imunoanalytické technologie jsou u některých typů imunoanalytických metod blíže vysvětleny principy generovaní jejich signálu a detekce.
Literatura
- Lapčík O. Od vyvrácené hypotézy k Nobelově ceně. Vesmír 2009:88, 704-707.
- Zichová M., Šafarčík K., Hušák V. Vyšetřovací metody in vitro v nukleární medicíně. Institut pro další vzdělávání pracovníků ve zdravotnictví, 1993, 124 p.
- Wild D. (Ed.). The Immunoassay Handbook, 3rd Edition. Elsevier Ltd., 2005, 930 p.
ANALYTICKÉ A KLINICKÉ PARAMETRY
Autoři: Radek Kučera, Marie Karlíková
U imunoanalytických laboratorních metod je třeba znát jejich analytické parametry, které rozhodují o jejich použití a stupni správnosti a specifičnosti získaných výsledků a tedy o spolehlivosti určité metody pro konkrétní použití. Tyto parametry mají být též pravidelně kontrolovány.
Nejdůležitější analytické parametry jsou popsány v následujících odstavcích.
Citlivost stanovení
(senzitivity)
Citlivost stanovení je určena podílem změny měřené odezvy přístroje a odpovídající změny koncentrace sledovaného analytu, neboli směrnicí kalibrační závislosti (u metod s dostatečně lineárním kalibračním vztahem) . Čím je číselná hodnota směrnice větší, tím je metoda citlivější, neboť menší přírůstek koncentrace vyvolá měřitelnou odezvu.
Citlivost také udává minimální množství analytu, který můžeme přesně odlišit od nulového množství analytu. Její znalost je důležitá pro určení rozsahu koncentrací, které lze danou metodou stanovit. Je dána především použitým analytickým principem.
Analytická citlivost
(analytical sensitivity)
Analytická citlivost (tj. citlivost měřící soupravy) se zjišťuje opakovaným stanovením nulového standardu a je definována jako průměr koncentrací nulového standardu +2 SD (směrodatné odchylky) nebo +3 SD. U komerčních testů je její hodnota deklarovaná výrobcem.
Funkční citlivost
(functional sensitivity)
V praxi se často setkáváme s tím, že deklarovaná analytická citlivost metody není při rutinním stanovení dosahována. Proto byla zavedena definice funkční citlivosti. Nejčastěji se definuje jako nejnižší koncentrace ve stanovení, pro kterou je variační koeficient nižší než 20%.
Správnost a bias
accuracy
Správnost metody udává, jak blízko skutečné hodnotě analytu je průměrná hodnota stanovené koncentrace. Pokud existuje absolutní metoda k získání skutečné hodnoty analytu, je možné využít srovnání obou metod k zjištění správnosti daného analytické metody (např. HPLC - vysokoúčinná kapalinová chromatografie). V mnoha případech je možné jen nepřímé určení správnosti analytické metody (recovery, test ředění).
Bias (z angl. zkreslení, vychýlení, posun) udává míru rozdílu naměřených hodnot od skutečných hodnot daného analytu. Pokud se naměřené hodnoty liší v průběhu celého stanovení o stejné procento koncentrace, jedná se o bias proporcionální. Pokud se naměřené hodnoty liší v průběhu celého stanovení o stejný počet jednotek, jedná se o bias konstantní. Oba typy bias se mohou vyskytovat ve stanovení současně.
Recovery
Tento anglický výraz se někdy nahrazuje českým označením testu jako metoda standardního přídavku. Slouží k nepřímému hodnocení správnosti analytické metody. Provádí se tak, že se k definovanému množství analytu o známé koncentraci přidá přesné množství stejného analytu opět o známé koncentraci. Naměřené navýšení koncentrace se pak vydělí vypočteným očekávaným navýšením koncentrace. Po vynásobení 100 pak vychází výsledné recovery v procentech. V ideálním případě je recovery 100%.
Test ředění
Další možností nepřímého testování správnosti metody je test ředění. Ředěním původního vzorku připravíme řadu vzorků o sestupné koncentraci. Po stanovení všech vzorků vynásobíme ředěné vzorky příslušným ředícím faktorem. Výsledné koncentrace ředěných vzorků vynásobené ředícím faktorem by se měly rovnat původní koncentraci vzorku, ze kterého se při ředění vycházelo. Jako výchozí vzorek k ředění se obvykle volí vzorek s koncentrací v horní části kalibrační křivky. Vytvořením řady vzorků o sestupných koncentracích získáme přehled o správnosti stanovení v celém kalibračním rozsahu dané analytické metody.
Přesnost a nepřesnost
precision, imprecision
Přesnost charakterizuje opakovatelnost dané analytické metody. Zjišťuje se pomocí opakovaného stanovení vzorku o stejné koncentraci. Vyjadřuje se v procentech jako variační koeficient (%CV) nebo jako standardní odchylka (SD) určité hladiny analytu. Přesnost či nepřesnost stanovení je ovlivněna řadou faktorů, mezi které patří: přesnost pipetace, vlivy během jednotlivých kroků analytického postupu (inkubace, třepání, separace, detekce), dále pak charakteristika protilátky, interference, preanalytické vlivy.
Přesnost ve stanovení
within run (im)precision, opakovatelnost
Zjišťuje se opakovanou analýzou vzorku o stejné koncentraci. Doporučuje se 20 opakovaných měření.
Přesnost mezi stanoveními
between run (im)precision, reprodukovatelnost
Zjišťuje se opakovanou analýzou vzorku o stejné koncentraci v každém stanovení, každý den. Pokud se vzorek stanovuje v duplikátech, triplikátech apod., používá se do výpočtu obvykle průměr naměřených hodnot.
Profil přesnosti
precision profile
Pokud chceme postihnout přesnost metody v celém rozsahu stanovení, používá se pro tento účel profilu přesnosti. K výpočtu se používá rozdíl koncentrací duplikátů rutinních vzorků, které se rozdělí do skupin podle koncentrace. Výsledkem jsou variační koeficienty těchto skupin, které pokrývají celý rozsah kalibrační křivky.
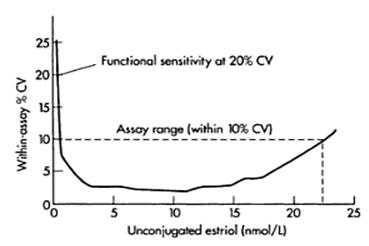
Obrázek 8. Profil přesnosti (zdroj: Wild D. (Ed.) 2005, str. 108).
Zdroje nepřesností
Zdrojem nepřesností může být každá složka analytické reakce (reagencie) a každý krok analytického postupu včetně lidského faktoru.
Reagencie: senzorová protilátka, konjugát s protilátkou, promývací roztok, substrátová soustava, standardy, kontrolní vzorky
Reakce antigen-protilátka: čas, teplota, separace, promývání
Enzym substrátová reakce: čas, teplota, světlo či tma
Detekce: měřič radioaktivity, spektrofotometr
Výpočet dat: vynesení dat na osy x a y, proložení kalibrační křivky
Pipetace: kalibrace, nastavení a reprodukovatelnost pipet či pipetoru
Interference
Imunoanalytickou reakcí stanovujeme velmi malé množství analytu (10-15 až 10-20 mol/l). Interference jsou proto rušivým elementem, na který je potřeba nezapomínat. S interferencemi se musí vyrovnat výrobci i uživatelé imunoanalytických souprav. Nespecifické interakce vznikají většinou v nevyhovujících vzorcích. Hemolytické, lipemické a ikterické vzorky by se neměly ke stanovení používat.
Specifické interakce se týkají použitých protilátek a jsou uvedeny níže.
Autoprotilátky: V některých případech u pacienta může dojít k vytvoření protilátek proti analytu, který je stanovován. Tyto autoprotilátky mohou interferovat při stanovení analyzovaného antigenu.
HAMA protilátky (Human Anti-Mouse Antibodies): Mohou se vyskytovat u pacientů u nichž byla užita k diagnostickým nebo terapeutickým účelům myší (ev. i jiná zvířecí) protilátka. Podobné protilátky se mohou vyskytovat i u osob, které byly např. pokousány domácími zvířaty. HAMA protilátky způsobují u některých stanovení falešně pozitivní výsledky.
Zkřížená reakce (Cross-reactivity): Protilátka rozpoznává epitop na antigenu. Jestliže epitop je společný i pro jiné molekuly, dochází ke zkřížené reakci. Tento problém se vyskytuje zejména u protilátek polyklonálních. Výběr vhodných monoklonálních protilátek tento problém zmenšil.
Hook efekt: Speciální problém u analytů s velmi širokým koncentračním rozsahem. Při extrémně vysokých koncentracích mohou být vazebná místa saturována antigenem a protilátka nemůže vytvářet komplex antigen - protilátka. Konečné výsledky jsou podhodnocené.
Nejistota měření
V praxi nejsou žádná měření absolutně přesná. Nejrůznější vlivy způsobují odchylku mezi skutečnou a naměřenou hodnotou. Výsledek měření se tak vždy pohybuje v jistém rozmezí kolem skutečné hodnoty. Nejistota měření udává rozsah naměřených hodnot kolem výsledku měření. Nejistota měření se netýká pouze výsledku, ale i měřicích přístrojů, použitých konstant, zavedených korekcí apod. Nejistota měření se zjišťuje statistickými výpočty. Předpokládá se určitá pravděpodobnost, s jakou se v intervalu daném nejistotou může nacházet skutečná hodnota měřené veličiny.
Mírou nejistoty měření je směrodatná odchylka (SD). Takto vyjádřená nejistota se označuje jako standardní nejistota (u). Udává se buď samostatně bez znaménka, nebo se znaménkem ± za výsledkem. Standardní nejistoty se dělí na několik typů. Standardní nejistoty typu A (uA), které jsou způsobovány náhodnými chybami a se stoupajícím počtem opakovaných měření se zmenšují.. Typ B (uB) vychází z různých známých a odhadnutelných příčin a výsledná nejistota je dána jejich součtem a nezávisí na počtu opakovaných měření. Kombinovaná standardní nejistota (uC) je součtem nejistot typu A a B. Hodnotí-li se výsledek měření touto nejistotou, není třeba rozlišovat mezi typem A a B. Kombinovaná standardní nejistota udává interval, ve kterém se s velkou pravděpodobností bude vyskytovat skutečná hodnota měřené veličiny. V praxi se tato nejistota užívá nejčastěji.
Referenční meze
Při hodnocení laboratorních výsledků nás zajímá, zda je naměřená hodnota normální, zvýšená či snížená. Výsledek je tedy třeba porovnat s rozmezím normálních hodnot. Podle způsobu, jak se toto rozmezí určuje, hovoříme buď o referenčních hodnotách nebo o rozhodovací hladině (cut off level). Jako referenční rozmezí je nejčastěji definován centrální 95% interval referenční populace t.j. hodnoty mezi 2.5 až 97.5 percentilem. Do referenční populace pak zahrnujeme nejčastěji zdravé jedince. Určování referenčního rozmezí v populaci zdravých osob, doporučovaný nejmenší počet je 120 jedinců, se provádí tak, že všechny naměřené výsledky seřadíme vzestupně a na spodním i horním konci výsledkové řady odřízneme 2,5 % výsledků. Uvnitř referenčního rozmezí zůstane právě požadovaných 95 % výsledků. Krajní hodnoty výsledkové řady představují dolní a horní referenční mez. Je třeba si rovněž uvědomit, že u některých analytů závisí referenční rozmezí na věku, jindy se liší u mužů a u žen. Referenční rozmezí se může lišit i v závislosti na použité metodě. Každá laboratoř by proto měla uvádět své referenční hodnoty.
Cut off
Od referenčního rozmezí je třeba odlišovat tzv. rozhodovací hladiny (cut off). Je-li rozhodovací hladina překročena, významně narůstá riziko přítomnosti určitého onemocnění. Cut off se používá např. při hodnocení sérových hladin nádorových markerů. U nádorových markerů se někdy využívá individuální cut off. U pacienta po operačním odstranění nádoru se opakovaně stanoví hladina nádorového markeru. V dalším sledování lze odhadnout individuální cut off nádorového markeru typickou pro daného jedince bez přítomnosti nádoru. Překročení této individuální cut off pak může znamenat recidivu nádoru, i když hodnota ještě nepřekročila cut off pro referenční populaci.
Hraniční výsledky
Pokud je referenční rozmezí definováno jako centrální 95% interval referenční populace, je třeba si uvědomit, že u 5 % zdravých jedinců najdeme výsledek, který se nachází mimo referenční rozmezí. Je třeba si to uvědomit při hodnocení výsledků, které jsou těsně nad nebo pod referenčním rozmezím. Jedná se tedy o individuální odchylku, nikoliv přítomnost onemocnění. K odlišení takových jedinců se v praxi doporučuje opakování laboratorního testu s určitým časovým odstupem.
Biologická variabilita
Schopnost testu dát při dvou po sobě jdoucích opakovaných měření shodné výsledky je ovlivněna řadou faktorů. Nejvýraznějším z nich je biologická variabilita. Biologické vlivy, dělíme na neovlivnitelné a ovlivnitelné.
Neovlivnitelné podmínky:
Biologické rytmy – cirkadiánní rytmus, sezónní vlivy, menstruační cyklus
Pohlaví – např. rozdílné hodnoty hormonů
Věk – hladiny některých analytů se během života jedince mění, mění se proto také příslušné referenční meze pro danou věkovou kategorii
Rasa – některé laboratorní parametry se liší v černošské, bílé či asijské populaci apod.
Vlivy prostředí – nadmořská výška, expozice slunečnímu záření atd.
Ovlivnitelné podmínky
Poloha těla – ovlivňuje sekreci katecholaminů, kortizolu, reninu
Fyzická zátěž a tělesná aktivita - ovlivňuje složení tělních tekutin a je závislá na délce a intenzitě
Těhotenství – zahrnuje výraznou změnu biochemických pochodů a změny celé řady parametrů
Kouření - kouření zvyšuje hladiny kracinoembryonální antigenu (CEA) a některých hormonů, naopak snižuje koncentraci imunoglobulinů
Alkohol - změny obsahu analytů závisí na intenzitě a délce konzumace alkoholu, jednorázové požití alkoholu v mírné a střední dávce ovlivňuje měření jen minimálně
Vliv léků – pokud je antigenní struktura exogenní látky shodná s endogenně produkovanou látkou, je výsledná hodnota testu ovlivněná, obvykle zvýšená (inzulín, hormony štítné žlázy)
Mechanické vlivy (vliv diagnostických a terapeutických zásahů) – např. zvýšení jladiny PSA po palpalčním vyšetření prostaty
Mentální stres - zvyšuje sekreci hormonů aldosteronu, angiotenzinu, katecholaminů, kortizolu, prolaktinu, reninu, inzulinu
Stravovací návyky - hormony a enzymy se vyplavují a přesouvají před příjmem potravy i během její konzumace
Klinická senzitivita a specificita
Při provádění studie jsou testováni jak zdraví, tak nemocní jedinci. U většiny zdravých jedinců vyjde výsledek testu (např. biomarkeru) negativní (jedinec nemá sledovanou nemoc) a podobně u nemocných vyjde výsledek testu pozitivní (jedinec má sledovanou nemoc). Avšak u určitého procenta zdravých vyjde výsledek testu pozitivní (označujeme je jako falešně pozitivní – FP) a podobně u určitého procenta nemocných vyjde výsledek negativní (falešně negativní, FN). Tyto vztahy jsou znázorněny v tabulce 2.
Tabulka 2. Vztah mezi stavem jedince a výsledkem testu.
|
|
Pacient s pozitivním výsledkem |
Pacient s negativním výsledkem |
Celkem |
|
Nemocný jedinec
|
TP |
FN |
TP + FP |
|
Zdravý jedinec
|
FP |
TN |
FN + TN |
|
Celkem
|
TP + FP |
FN + TN |
TP + FN + TN + FN |
správně pozitivní (TP), falešně pozitivní (FP), správně negativní (TN), falešně negativní (FN)
Klinická senzitivita je schopnost testu správně určit nemocné jedince, jinými slovy počet správně nemocných.
![]()
Místo senzitivity se někdy používá výraz detection rate (DR) nebo true positivity rate.
Klinická specificita je schopnost testu správně vyloučit jedince, kteří nemají dané onemocnění, jinými slovy počet správně zdravých.
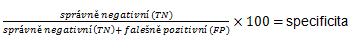
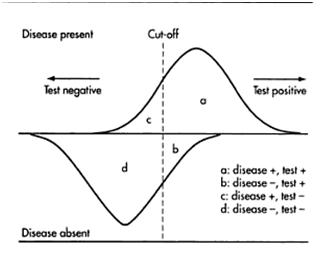
Obrázek 9. Klinická senzitivita a specificita (zdroj: Wild D. (Ed.) 2005, str. 127).
Efektivita testu
Procento správně klasifikovaných pacientů jako zdravých nebo nemocných![]()
Prediktivní hodnoty
Je třeba určit pravděpodobnost, že stanovení poskytne správnou diagnostickou informaci.
Zahrnují klinickou senzitivitu, specificitu, a efektivitu testu
Pozitivní prediktivní hodnota (PPV)
Pravděpodobnost, že osoba je opravdu nemocná, když test reagoval pozitivně

Negativní prediktivní hodnota (NPV)
Pravděpodobnost, že osoba je zdravá při negativním výsledku testu
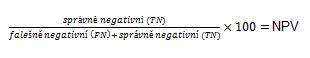
ROC křivka
eceiver operating characteristic curve
ROC křivka je grafické vyjádření umožňující posoudit vypovídací schopnost diagnostického testu v závislosti na jeho senzitivitě a specificitě.
Na svislé ose grafu je relativní četnost skutečně pozitivních případů (TP), tedy pravděpodobnost, že jako správný bude vyhodnocen pozitivní případ.
Na vodorovné ose je relativní četnost falešně pozitivních případů (FP), tedy pravděpodobnost, že jako správný bude vyhodnocen negativní případ.
Na grafu ROC se bude nejlepší diagnostický test vyznačovat ROC křivkou s největší plochou pod křivkou (Area Under Curve – AUC). Je-li plocha rovná 1, je test ideální a má 100% senzitivitu i specificitu. Pokud je plocha pod křivkou 0,5 pak není test lepší než házení mincí. V praxi bude diagnostický test někde mezi těmito extrémy.

Obrázek 10. ROC křivky (zdroj: Wild D. (Ed.) 2005, str. 127).
NÁVAZNOST MĚŘENÍ
Autoři: Kristián Šafarčík, Vladimír Bartoš
Obdobně jako v každé oblasti aplikované metrologie je i v případě provádění imunoanalytických kvantitativních měření různých veličin (analytů) základním požadavkem zajištění jednotnosti a správnosti měření. Důsledkem tohoto požadavku pak je dosažení smysluplné úrovně vzájemné srovnatelnosti výsledků a to jak mezi výsledky měření stejné veličiny prováděnými v jedné laboratoři ale v různém čase, tak také při měřeních realizovaných v různých laboratořích.
Předpokladem pro dosažení takového stavu je, aby různé rutinní postupy používané
k měření určité veličiny měly vazbu na mezinárodně uznávaný a platný referenční materiál. Tato vazba je založena na neporušené hierarchii měřicích postupů a kalibrátorů, směřující od primárního referenčního materiálu nejvyššího metrologického řádu ke kalibrátorům řádů nižších. V této nepřerušené posloupnosti je tak hodnota veličiny referenčního materiálu pomocí odpovídajících měřicích procedur postupně přenášena na kalibrátory nižšího řádu a končí až na úrovni měřicího postupu, určeného k rutinnímu měření běžných vzorků. Hodnota primárního standardu je pomocí primární referenční metody odvozena přímo od odpovídající jednotky SI. Současně s přenosem hodnot kalibrátoru je na každém stupni stanovena nejistota těchto hodnot, která se postupně, směrem ke kalibrátorům nižšího řádu, zvyšuje. Existence výše popsané posloupnosti je základem vlastnosti, označované pojmem metrologická návaznost. Ve smyslu definice podle mezinárodního metrologického slovníku (VIM ) se metrologickou návazností rozumí vlastnost výsledku měření nebo hodnoty etalonu, která umožňuje určit jejich vztah k uvedeným referencím, zpravidla národním nebo mezinárodním etalonům, a to pomocí nepřerušeného řetězce porovnávání, jejichž nejistoty jsou uvedeny.
Schematicky je model hierarchie kalibrací a návaznosti na jednotku SI zobrazen
na Obrázku 11.
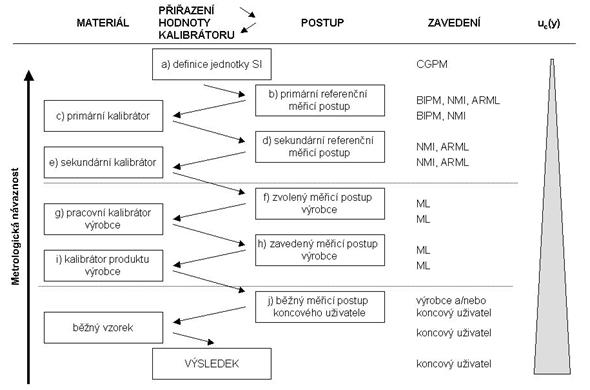
Obrázek 11. Hierarchie kalibrace a metrologická návaznost na SI. (převzato podle ČSN EN ISO 17511:2004; CGPM – Všeobecná konference pro váhy a míry, BIPM – Mezinárodní úřad pro váhy a míry, NMI – národní metrologický institut, ARML – akreditovaná referenční měřicí laboratoř, ML – laboratoř výrobce)
Bohužel v případě měření, která bývají realizována pomocí imunoanalytických metod, je prokázání návaznosti často velmi problematickou úlohou. V praxi je stanovováno mnoho veličin (analytů), pro které nejsou dostupné certifikované primární referenční materiály ani měřící postupy. Díky tomu nemohou být tyto veličiny ani „kompletně“ návazné až na jednotku SI a jejich návaznost končí v hierarchii kalibrací na některém z nižších stupňů. Těmi mohou být referenční materiály konvenčně přijaté nějakou obecně uznávanou autoritou (například organizací WHO), nebo v horším případě jen pracovní kalibrátory výrobce IVD.
Problematikou zajišťování návaznosti měření v oblasti laboratorní medicíny se zabývá Joint Commitee for Traceability in Laboratory Medicine (JCTLM), fungující na základě společné deklarace tří mezinárodních organizací – CIPM, IFCC a ILAC. Cílem JCTLM je podpořit dosažení srovnatelnosti a standardnosti výsledků měření v laboratorní medicíně v zájmu naplnění požadavků směrnice Evropské komise 98/79/EC (EC IVDD). Jedna ze dvou pracovních skupin JCTML-WG1 „Referenční materiály a referenční postupy“ poskytuje přehledy, seznamy, charakteristiky a literární informace o existujících referenčních materiálech a metodách. V databázi přístupné na stránkách JCTLM jsou k dispozici informace o referenčním materiálech a referenčních metodách [http://www.bipm.org/jctlm/].
Standardizace imunoanalytických metod
Standardem se obecně rozumí určovaná látka (analyt) s deklarovanou koncentrací.
Musí jít o čistý, homogenní, stabilní preparát analyzované látky, který má v ideálním případě definovanou strukturu a molekulovou hmotnost. Tato podmínka však v mnoha případech v praxi nemůže být splněna. Lze proto hovořit o dvou skupinách standardů v závislosti na vlastnostech látek, ze kterých jsou připravovány a pro jejichž stanovení jsou používány.
Do první skupiny patří látky se známým složením (tím i strukturou a molekulovou hmotností), které mohou být produkovány chemickou syntézou s velmi vysokou čistotou (99,9%). Příkladem mohou být jednodušší biologicky aktivní látky, jako jsou steroidy, thyreoidální hormony nebo léky, které jsou komerčně dostupné v čisté formě. Tyto látky mohou sloužit pro i přípravu primárních standardů nejvyšší metrologické kvality. Pracovní roztoky standardů (kalibrátory pro měřicí metodu) je možno připravit rozpuštěním přesné navážky standardu v přesně známém objemu vhodného rozpouštědla.
Do druhé skupiny patří látky, jejichž struktura naopak není úplně jednoznačně definovatelná. Tyto látky není možné připravit chemickou syntézou a získávají se tak jinými postupy, například izolací z biologických materiálů, často s obtížným zajištěním reprodukovatelnosti výsledku. U těchto preparátů mohou nastávat problémy s homogenitou, znečištěním látkami s příbuznými vlastnostmi, prekursory a metabolity. Takovéto látky nemohou být dostatečně definovány chemickými a fyzikálními metodami, takže u nich není možné zajistit návaznost na jednotku SI a pro numerické vyjadřování velikosti odpovídajících veličin jsou pak používány mezinárodně dohodnuté jednotky (IU). Tak je tomu např. u řady složitějších biologicky aktivních látek jako například proteinových či peptidických hormonů, nádorových markerů bílkovinné povahy apod. Ze skutečnosti, že se v těchto případech nejedná o adekvátně definované analyty pak vyplývá i fakt, že pravá hodnota měřené veličiny je v těchto případech tudíž reálně neznámá.
Z hlediska použití standardu v imunoanalytické metodě je rovněž nutným požadavkem, aby se jednalo o preparát, který je v maximální míře imunochemicky shodný s určovanou látkou.
Pro analyty, které bývají stanovovány imunoanalytickými metodami, jsou referenční metody a primární referenční materiály zatím dostupné pro měření koncentrací velmi omezeného počtu látek nepeptidické povahy, jako jsou například:
- celkový tyroxin (T4 celkový)
- aldosteron
- testosteron
- 17-β-estradiol
- progesteron
- kortizol
Pouze u těchto látek tak existuje předpoklad pro zajištění návaznosti jejich měření
až na jednotku SI. V ostatních případech (bez takovéto návaznosti) nelze dosáhnout dostatečné míry jednotnosti a vzájemné porovnatelnosti výsledků měření. I když byly pro některé z těchto látek připraveny a schváleny mezinárodní referenční materiály, není tato skutečnost vzhledem k charakteru analytu automatickým předpokladem zajištění vzájemné porovnatelnosti výsledků měření.
Vedle problémů spojených jednoznačným definováním stanovovaného analytu jako chemického individua existují rovněž problémy spojené s přípravou vhodných pracovních kalibrátorů a kontrolních materiálů a s jejich komutabilitou, projevující se například rozdílnou imunoreaktivitou referenčních materiálů nebo kalibrátorů a měřených nativních vzorků.
Kalibrační materiály jsou často připravovány izolací z produkčních žláz a tkání a nejsou například glykosylovány, zatímco zkoušené biologické materiály ano. Purifikace analytů po jejich izolaci může vést k částečné nekontrolovatelné degradaci. I látky připravované rekombinantními technikami, "pozměňují" často svoji strukturu, a v důsledku toho se zvyšuje pravděpodobnost výrazných vlivů matrice.
Významnou roli pro zhoršenou porovnatelnost výsledků imunoanalytických metod sehrávají rovněž skutečnosti vyplývající z přímé podstaty imunochemické reakce, tedy vazby specifické protilátky a antigenu, ovlivněné nejen charakterem stanovovaného analytu, ale i vlastnostmi použitých protilátek. Ovlivňujícími faktory mohou být například:
- orientace protilátek k epitopům, nacházejícím se v málo stabilních oblastech proteinových molekul, například v oblastech podléhajících proteolýze v podmínkách in-vitro,
- orientace protilátek k oblastem, které nejsou nositeli specifických fyziologických vlastností molekul (hCG, TSH)
- používání protilátek, které nejsou schopné reflektovat různý stupeň glykosylace, ale i syalilace, sulfatace, degradace či agregace imunochemických analytů
- různá úroveň glykosylace často typická pro specifické chorobné stavy a projevující se často také přítomností různých izoforem imunochemického analytu (použité analytické systémy nejsou obvykle schopné postihnout ani základní poměr jednotlivých izoforem).
Konečně průběh imunochemické reakce může být poměrně zásadním způsobem ovlivněn také samotnými reakčními podmínkami, jako jsou například pH, iontové síly, přítomnost detergentů apod. Tyto vlivy nejsou někdy dostatečně známy a respektovány.
Ve svém důsledku jsou uvedené skutečnosti důvodem vysoké závislosti výsledků imunochemických měření na použitém analytickém systému (kombinace použitých protilátek, podmínky imunochemické reakce apod.). Z hlediska praktické aplikace tak u těchto metod neexistují předpoklady pro obecně akceptovatelné jednotné hodnoty referenčních intervalů a diagnostických rozhodovacích limitů.
IMUNOANALYTICKÉ METODY A TECHNOLOGIE
Autoři: Kristián Šafarčík, Vladimír Bartoš
Jako izotopové (nebo radioizotopové) metody jsou označovány ty metody, u kterých je pro přípravu indikátoru imunochemické reakce použit vhodný radionuklid některého prvku. Základní principy uplatňované u tohoto typu imunoanalýz jsou odpovídající modifikací těch variant, které byly zmíněny v obecné části o imunoanalytických metodách. Pro kompetitivní metody používáno označení "radioimunoanalýza" - RIA. Pro nekompetitivní metody bylo zavedeno označení "imunoradiometrická analýza" a zkratka IRMA.
Postupem času byly vyvíjeny a aplikovány i jiné principy generování a detekce signálu, potřebného pro kvantifikaci imunoanalytických metod, které nevyužívaly radioizotopy a měření radioaktivity. Zavádění neizotopových technik bylo často zdůvodňováno především snahou vyhnout se používání radionuklidů, které jsou obecně potenciálně ekologicky škodlivé a navíc ohrožují do určité míry laboratorní pracovníky radiační zátěží. Je však nutno konstatovat, že se ani některé neizotopové metody neobejdou bez užití potenciálně kancerogenních, nebo jinak nebezpečných látek. Při splnění obecných podmínek pro práci s otevřenými zářiči a likvidaci radioaktivních odpadů není riziko plynoucí z práce s radionuklidy zásadně větší než při práci s neizotopovými metodami, a je převyšováno rizikem plynoucím z práce s potenciálně infekčním materiálem (infekce HBV, HCV, HIV). Obdobně přístrojové vybavení je zhruba přibližně stejně drahé.
Zásadním přínosem izotopových metod je jejich ekonomická výhodnost a také fakt, že pro rutinní stanovení některých analytů alternativní neizotopové metody nejsou k dispozici.
Naopak přínosem některých neizotopových imunoanalýz je skutečnost, že dosahují lepší citlivosti stanovení (Obrázek 12). Byla využita celá řada látek, které teoreticky dosahují vyšší citlivosti detekce než je měření radioaktivity a látky používané pro značení mohou generovat větší množství signálu. Podstatnou výhodou neizotopových imunoanalýz je možnost jejich snazší automatizace.

Obrázek 12. Charakteristické citlivosti imunoanalytických metod. ELISA = Enzyme Linked Immunosorbent Assay, FIA = fluorescenční imunoanalýza, RIA = radioimunoanalýza, LIA = Luminiscenční imunoanalýza.
Neizotopové metody
Neizotopové metody, jak název napovídá, používají jako indikátor jiné než izotopové substance. Podle použitých látek definujeme tyto základní skupiny metod:
1. Enzymová imunoanalýza
2. Luminiscenční imunoanalýza
3. Fluorescenční imunoanalýza
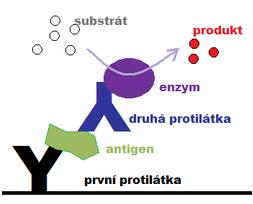
Enzymová imunoanalýza
Enzymová imunoanalýza (EIA) využívá jako indikátor enzym. Enzym je chemicky (kovalentně) vázán buď na antigen, nebo protilátku – vznikne enzymový konjugát . Uspořádání je možné jak kompetitivní, tak nekompetitivní. Enzym katalyzuje chemickou přeměnu substrátu, který je přidán do reakční směsi, na produkt, který je barevný. Stanovuje se pak spektrofotometricky (viz chromogenní substrát), nebo na základě fluorescence (fluorimetrické stanovení). Koncentrace produktu je úměrná koncentraci antigenu nebo protilátky ve vzorku.
Heterogenní enzymové imunoanalýzy
Po proběhnutí imunochemické reakce (inkubaci) je z reakční směsi obvykle odstraněna volná frakce indikátoru většinou s využitím pevné fáze. Následuje přídavek enzymového substrátu a po pevně určené době je reakce mezi enzymem a substrátem zastavena (např. přidáním "stop" činidla) a spektrofotometricky je měřeno zeslabení monochromatického světla roztokem. Pomocí kalibrační křivky lze poté odečítat koncentrace analyzovaných vzorků.
Nejznámější heterogenní enzymovou imunoanalýzou je ELISA (Enzyme-Linked ImmunoSorbent Assai). Existuje mnoho variant této metody, společným znakem je zakotvení (adsorpce nebo kovalentní navázání) antigenu nebo protilátky na nerozpustný nosič (často povrch reakční nádobky nebo mikrotitrační destičky), což usnadňuje separaci imunochemicky navázaných molekul.
Na Obrázcích 13 a 14 jsou schematicky znázorněny metody ELISA: nekompetitivní sendvičová, nejčastěji používaná pro stanovené antigenů s více než jednou antigenní determinantou, a capture ELISA pro stanovení protilátek.
Obrázek 13 Schéma sendvičové ELISA pro detekci antigenů (zdroj: www.wikiskripta.eu)

Obrázek 14 Schéma capture ELISA pro detekci protilátek (zdroj: www.wikiskripta.eu)
Homogenní enzymové imunoanalýzy
Využívají efekty, při kterých dochází ke změně aktivity enzymu v imunokomplexu. Příkladem může být stínění aktivního místa enzymu - situace, kdy je vlivem stérických podmínek během imunochemické reakce ovlivněna aktivita enzymového konjugátu a tím i rychlost přeměny enzymového substrátu na produkt. Vzorek obsahující stanovovanou látku je v reakční směsi smíchán s indikátorem, kterým je konjugát vhodného enzymu se stanovovaným antigenem. V kompetitivní reakci pak spolu oba soutěží o limitované množství vazebných míst protilátky. Část enzymového konjugátu zůstává volná (její množství je závislé na množství stanovované látky v analyzovaném vzorku) a může tak reagovat se substrátem. Frakce konjugátu navázaná na protilátku pak, vzhledem k zastínění aktivního centra enzymu, enzymovou aktivitu nevykazuje (Obrázek 15).
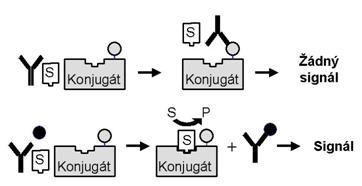
Obrázek 15. Homogenní enzymová imunoanalýza - stínění aktivního místa enzymu. S = substrát, P = produkt
Enzymová aktivita je tedy tím vyšší, čím větší je množství stanovovaného antigenu v analyzovaném vzorku, protože na protilátku se ho naváže více a naopak v nenavázané formě zůstane více enzymového konjugátu. Enzymová aktivita v reakční směsi je tedy přímo úměrná množství analyzovaného antigenu.
Z hlediska provedení jsou homogenní EIA jednoduché, avšak mnohem méně citlivé než metody heterogenní. Užívají se ke stanovení nízkomolekulárních látek (léků, hormonů a metabolitů). Příkladem je metoda CEDIA (Cloned Enzyme Donor Immunoassay) nebo EMIT (Enzyme Multiplied Immunoassay Technique), využívané např. v toxikologii.
Enzymové konjugáty
Klíčovým problémem EIA je právě příprava vhodných enzymových konjugátů, tedy látek, kde je enzym chemicky vázán na stanovovaný antigen nebo protilátku. Základní podmínkou úspěšné EIA je rovněž výběr vhodného enzymu, který musí splňovat řadu obecných podmínek:
- musí mít vysoké číslo přeměny,
- aktivita enzymu musí být přesně a snadno měřitelná
- enzym musí zachovávat enzymovou aktivitu po vazbě na antigen nebo protilátku (heterogenní EIA), nebo enzymová aktivita musí být výrazně modulována vazbou konjugátu na protilátku (homogenní EIA)
- enzym musí být snadno dostupný
- enzym se nesmí vyskytovat v tělní tekutině, ve které je prováděno vyšetření
U homogenních EIA se jako enzymy používají například glukozo-6-fosfátdehydrogenáza nebo malátdehydrogenáza. Nejčastěji používanými enzymy v heterogenní EIA jsou křenová peroxidáza nebo alkalická fosfatáza.
Jak fungují enzymy v EIA
Křenová peroxidáza katalyzuje reakci peroxidu vodíku s vhodným substrátem, který se oxiduje na barevný produkt. Substráty jsou například TMB (3,3',5,5' tetramethylbenzidin), ABTS (2,2' azino-bis-(3-etylbenzthiazolin-6-sulfonát) nebo OPD (o-fenylendiamin).
Alkalická fosfatáza v enzymatické reakci štěpí esterickou vazbu kyseliny fosforečné (např. štěpí bezbarvý para-nitrofenylfosfát na žlutý para-nitrofenol, fotometrická detekce při 420 nm). Štěpením umbelliferylfosfátu vzniká umbelliferon, který fluoreskuje a dá se měřit fluorometricky.
Detekce enzymatických imunoanalýz
Kolorimetrická (fotometrická) detekce je nejrozšířenější typ detekce u klasických enzymoimunoanalýz. Principem detekce je zeslabení intenzity světelného toku monochromatického světla zbarveným roztokem produktu enzymatické reakce. Přístroje pro měření absorbance se nazývají spektrofotometry.
Nefelometrická detekce využívá enzym lysozym a jako substrát peptidoglykany. Jako substrátu bylo využito fragmentů buněčných stěn bakterií Micrococcus luteus. Paprsek monochromatického světla (např. laserového zdroje) je rozptylován v zakaleném roztoku částic. Míra rozptylu světla je úměrná množství částic, tedy aktivitě enzymu. Moderní nefelometry jsou vybaveny laserovými zdroji přísně monochromatického světla, což zjednodušuje další konstrukci přístrojů.
Fluorometrická detekce umožňuje dosažení vyšší citlivosti při použití stejného enzymu.
Tento nebo obdobný princip detekce je využíván v celé řadě analytických systémů, například technologie MEIA (Microparticle Enzyme Immunoassay) na analyzátorech IMx a AxSYM firmy Abbott (Obrázek 16).

Obrázek 16. Přístroj AxSYM (Abbott Laboratories..)
Luminometrická detekce využívá efektu bioluminiscence, spojené s enzymatickou reakcí. V tomto případě se však jedná o chemiluminiscenci, kdy je světelné záření produkováno během enzymatické reakce. V praxi jsou pro tyto účely nejpoužívanějšími enzymy alkalická fosfatáza a křenová peroxidáza. Tento princip je využíván například u analyzátorů řady IMMULITE firmy DPC nebo analyzátorů Access firmy Beckman – Coulter (Obrázek 17).

Obrázek 17. Přístroj Access (Beckman Coulter.
Při použití enzymu křenové peroxidázy, dochází v přítomnosti peroxidu vodíku k oxidaci luminolu. Při reakci je však produkce světelného záření slabá. Byla ale objevena řada látek (luciferin, benzthiazoly,...), které zesilují a prodlužují produkci světelných kvant této oxidační reakce. Reakce dává s použitím těchto zesilovačů kontinuální výstup světelného signálu, který může být měřen i s časovým odstupem. Tyto metody jsou pak označovány jako zesílená chemiluminiscence, "enhanced chemiluminescence". Tento systém byl propracován firmou Amersahm a byl dodáván na trh pod označením Amerlite. Nyní tento princip využívá analyzátor Vitros ECi firmy Ortho-Clinical Diagnostics (Obrázek 18).

Obrázek 18. Vitros ECi (Ortho-Clinical Diagnostics)
Luminiscenční imunoanalýza
Luminiscence
Luminiscence je fyzikální jev, kdy látka, označovaná jako luminofor, je schopná produkovat světelné záření. Toto generování světelných záblesků je obvykle iniciováno změnou vnějších podmínek (pH, teploty, elektrického potenciálu apod.), která ovlivní fyzikálně-chemické vlastnosti některých molekul luminoforu. Dříve stabilní látka se tak dostane do energeticky nestabilního stavu s přebytkem vnitřní energie, kterou samovolně uvolňuje vyzářením elektromagnetického záření o vlnové délce v oblasti viditelného světla. Tímto procesem se molekula látky opět stabilizuje, i když v pozměněné podobě.
K měření luminiscence slouží přístroje nazývané luminometry. Jak vyplývá z podstaty jevu, nevyžaduje měření luminiscence žádný excitační zdroj záření, měří se pouze světlo produkované luminoforem.
Jako luminoimunoanalytické metody lze označit ty metody, u kterých je pro značení indikátoru imunochemické reakce použit luminofor. Jak bylo uvedeno výše, jsou však mezi luminoimunoanalýzy často zahrnovány rovněž enzymové imunoanalýzy s luminometrickou detekcí.
Základní principy uplatňované u LIA jsou modifikací těch, které byly zmíněny v obecné části o imunoanalytických metodách. Z hlediska použitého luminoforu je možno LIA metody rozdělit na metody bioluminiscenční a chemiluminiscenční.
Chemiluminiscenční metody
Chemiluminiscenční metody využívají jako luminofory různé látky, které jsou k produkci světelného záření iniciovány na základě průběhu chemické reakce. Produkce světla chemickou reakcí je časově omezena a je proto nezbytné, aby měření proběhlo v určitém definovaném okamžiku.
Mezi látky, které vykazují luminiscenci, patří např. již zmíněný luminol, izoluminol, lucigenin, sulfonamidy nebo estery akridinových barviv. Luminiscence umožňuje detekci látek v koncentraci do 10-18 mol.L -1. V praxi je tento princip uplatněn v analyzátoru ACS:180 původní firmou Ciba Corning, nyní je dodáván firmou Bayer ve variantě ACS:180 SE nebo automat ADVIA Centaur a systému Architect i2000 firmy Abbott Diagnostics(Obrázek 19).

Obrázek 19. Analyzátor Architect i2000 (Abott Diagnostics).
Fluorescenční imunoanalýza
Základní principy uplatňované u fluorescenční imunoanalýzy (FIA) jsou modifikací těch, které byly zmíněny v obecné části o imunoanalytických metodách.
Fluorescence a její detekce
Fluorescence je fyzikální jev, kdy látka - fluorofor - je schopna absorbovat energii dodávanou ve formě elektromagnetického záření, (tzv. excitační záření), a následně vyzařovat elektromagnetické záření o jiné vlnové délce (emisní záření). Energetická spektra excitačního i emisního záření úzce souvisí se základní strukturou látky, přičemž emisní spektrum je posunuto do oblasti vyšších vlnových délek než spektrum excitační. Fotony absorbované souborem molekul jsou totiž z části degradovány na tepelnou energii, z části jsou vyslány jako fotony o nižší energii (vyšší vlnové délce), než jakou měl foton původní. Rozdíl maxim excitačního a emisního fluorescenčního spektra se nazývá Stokesův posun. Podíl počtu emitovaných fotonů k počtu fotonů absorbovaných se nazývá kvantový výtěžek fluorescence ( n ) a může nabývat hodnot 0 a1.
Požadavky na fluorescenční indikátor vhodný pro použití ve FIA lze shrnout do tří podmínek:
- vysoká molární absorbance
- vysoký kvantový výtěžek
- velký Stokesův posun
Nejužívanějším fluorescenčním indikátorem je fluorescein. Exitační maximum má při 490 nm a emisní maximum při 520 nm. Některé sérové komponenty, (např. albumin-bilirubinový komplex), při těchto vlnových délkách interferují. Interference při měření biologických materiálů se mohou silně projevovat také rozptylem záření nebo jeho zhášením. Proto je měření fluorescence silně ovlivňováno prostředím, ve kterém se provádí. Klasická fluorescence vykazuje po krátkém excitačním osvitu určitou dobu dosvitu fluorescenčního signálu, která je rozdílná pro různé látky. Tento fluorescenční dosvit se u látek běžně vyskytujících v séru pohybuje v rozmezí 1 – 20 ns. U běžně používaných fluorescenčních indikátorů se pohybuje rovněž v řádu nanosekund (fluorescein 4,6 ns). Emisní spektra z různých fluorescenčních zdrojů séra tak mohou interferovat s emisním spektrem indikátoru nejen vzhledem k podobné vlnové délce svých píků, ale překrývají se rovněž časově a nedají se prakticky rozlišit.
Zcela zásadní přínos pro měření fluorescence má technika zvaná časově modulovaná detekce fluorescence (“time resolved fluorescence measurement“ - TR fluorescence), založená na použití nových fluorescenčních indikátorů - lanthanidových chelátů - zejména europia, samaria, terbia nebo thulia (Obrázek 2.6).
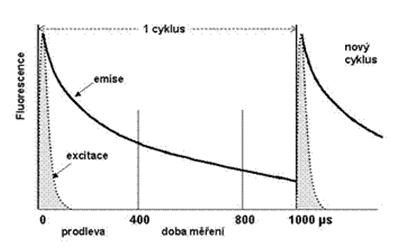
Obrázek 20. TR-fluorescence - časový průběh měření
Jejich zavedením se podařilo překonat problém fluorescenčního pozadí média, ve kterém se fluorescence měří. Jedná se o indikátory s velmi dlouhou fluorescencí, přičemž její detekce je časově modulovaná. Krátký světelný impuls ze světelného zdroje (xenonové výbojky) nebo pulzního laseru slouží jako excitační zdroj a fluorescence je pak měřena s určitým časovým odstupem.
Dosvit fluorescenčního indikátoru na bázi chelátů vzácných zemin je mezi 10 – 1000 µs. Excitační spektrum má velmi široký pík, emisní pík pak velmi úzký. Navíc Stokesův posun proti běžným fluorescenčním indikátorům je mnohem větší, pík emisního spektra je posunut až do červené oblasti viditelného spektra. Měření fluorescence, po časové prodlevě v intervalu 400 až 800 µs po osvitu, oddělí parazitní fluorescenci sérových komponent, které mají podstatně kratší dosvit. Excitační osvit se opakuje tisíckrát za sekundu. Problematikou TR fluorescence a její aplikací v imunoanalýze s využitím lantanidových chelátů jako indikátorů se velmi široce zabývala firma Wallac (ve spojení s firmami LKB a Pharmacia). Byl vyvinut imunoanalytický systém DELFIA, později využitý i u automatického analyzátoru AutoDELFIA. Tímto systémem ke možno v běžné reakční směsi detekovat koncentrace 10 -17 mol.L-1 Eu3+, což vysoce převyšuje detekční mez běžných fluorescenčních měření bez časové modulace (10-11 - 10 -12 mol.l -1).
Jedním z příkladů této realizace imunoanalytických metod je Fluorescence Polarization Immunoassay – FPIA. Tato kvantitativní analytická metoda využívá kombinace dvou principů - kompetitivní imunochemické reakce mezi stanovovaným analytem a vhodným indikátorem o vazebná místa na specifické protilátce a měření vertikálně polarizovaného fluorescenčního záření emitovaného po excitaci vzorku rovněž polarizovaným světlem.
Tato technologie je použitelná pro určení koncentrace malých molekul.
V kompetitivním uspořádání metoda poskytuje možnost stanovit koncentrace analytu bez nutnosti separace volné a vázané frakce fluorescenčního indikátoru. Postup byl vyvinut firmou Abbott a byl využíván v přístrojích TDx, IMx nebo AxSYM, které jsou používány pouze ojediněle.
Homogenní fluorescenční imunoanalýza
Mezi nejpokročilejší technologie homogenní imunoanalýzy patří technologie TRACE (Time Resolved Amplified Cryptate Emission) vyvinutá firmou CIS (Obrázek 21). Jako fluorescenční indikátory se používají kryptáty vzácných zemin, které vykazují dlouhotrvající fluorescenci v řádu 10 - 1000 µs, což umožňuje použití časově modulované detekce fluorescence.

Obrázek 21. Metoda TRACE
Pro praktické provádění imunoanalýz využívajících tento originální princip homogenní FIA byl vyvinut analyzátor KRYPTOR dodávaný nyní firmou B.R.A.H.M.S.
Multiplexové metody
autor: Jindra Vrzalová
Multiplexové měření – tedy měření více analytů zároveň - je logickým řešením pro popis komplexním fyziologických a patofyziologických dějů, kde nezáleží pouze na absolutní koncentraci jednotlivých členů, ale na poměrech agonistů a antagonistů, faktorů a jejich inhibitorů. Příkladem velmi komplexních regulací jsou cytokiny a růstové faktory. Cílem multiplexových analýz je
- popis zastoupení jednotlivých proteinů (deskriptivní proteomika),
- studium vzájemných vztahů proteinů,
- vyhledávání a validace biomarkerů,
- vyhledávání cílů terapie a
- klinická diagnostika.
Přínosem multiplexového typu měření je
- finanční efektivita,
- redukce potřebného času a práce pro analýzy,
- snížení objemu vzorku a
- validita dat při porovnávání poměrů hladin jednotlivých proteinů.
Multiplexové analytické technologie v oblasti proteinů jsou založeny na třech principech:
- imunoanalýza,
- separační technologie (chromatografie nebo 2D elektroforéza) a
- hmotnostní spektrometrie
nebo na jejich kombinacích.
V následujícím textu se budeme zabývat pouze multiplexovými přístupy založenými na imunoanalytických postupech. Představené technologie mají sloužit jako přehled principů, zvláštní pozornost je věnována technologii xMAP. Konkrétní chemikálie, reagencie a přístroje jsou dosažitelné od mnoha výrobců, jejich spektrum se stále vyvíjí a nejsou zde proto uváděny. Multiplexové měření je dnes nedílnou součástí mnoha výzkumů a v některých oblastech se začíná uplatňovat i v klinické rutinní praxi.

Obrázek 22. Srovnání několika typů multiplexových metod.
Planární mikroarraye – proteinové čipy
Proteinové čipy se vyvinuly z technologií připravených původně pro analýzu DNA. Protilátky nebo antigeny jsou naspotovány na planární povrch – silikonových čipů nebo skleněných sklíček s nitrocelulózovou membránou (FAST slides). Čipy jsou tedy prostorově uspořádané reagencie na pevném povrchu, v připadě imunoanalýzy obsahuje každá oblast neboli spot definovanou protilátku (antibody microarrays) nebo antigen. Přesná pozice (spot) specifické protilátky/antigenu na čipu definuje typ analytu, který je stanovován. Studované proteiny jsou kvantifikovány díky různým principům vytvářejícím signál a jeho zesílením – kolorimetricky, radioaktivitou, fluorescencí, chemiluminiscencí, enzymovými reakcemi atd. – a intenzita signálu je měřena určeným typem scanneru nebo kamery. Vyhodnocení vyžaduje speciální software, který vyhodnotí intenzitu signálu v daném spotu a porovná ji s kalibrační křivkou, pozitivní a negativní kontrolou popř. alespoň s ostatními spoty na čipu.
Čipové technologie můžou být rozděleny podle jejich filozofie přístupu:
- přímé technologie (forward phase arrays),
- reverzní technologie
- čipy pro studium proteinových interakcí.
Na čipech přímé technologie je inkubován vždy jeden vzorek na čipu, takže může být současně stanoveno větší množství proteinů. Na reverzních čipech je imobilizováno větší množství různých vzorků. V jednom kroku tak může být stanoven jeden konkrétní protein ve velkém množství vzorků zároveň. Tato technika je také používána s malými kousky tkání nebo kousků tkání získaných mikrodisekcí.
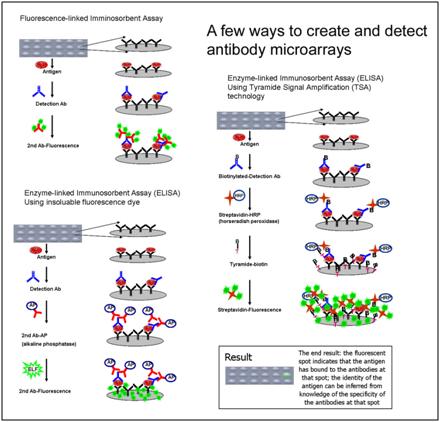
Obrázek 23. Protilátkové mikroarraye
Arraye na mikrotitračních destičkách
Jsou přímou modifikací ELISové technologie. V každé jamce destičky je na dně naspotováno až několik specifických protilátek, které vyváží sledované proteiny ze vzorku proteiny a na principu sandwichové reakce je umožněna chemiluminiscenční nebo fluorescenční detekce. Zástupcem je např. Thermo Scientific SearchLight Protein Array technologie, která umožňuje z 50 µl vzorku zachytit až 16 různých analytů, které jsou detekovány přidáním biotinylované protilátky, následované přidáním křenové peroxidázy a chemiluminiscenčního substrátu. Produkce světla je detekována CCD kamerou a analyzována pro každý spot speciálním softwarem. (www.piercenet.com/products; Moody M.D., 2001).
Multiplexové reakce na mikrokuličkách (Bead Arrays)
Mikrokuličky jsou velmi zajímavou alternativou k planárnímu uspořádání čipů. Používají detekci průtokovou cytometrií a jsou vhodné především pro projekty, kde je již studováno měnší množství proteinů – tedy pro studie více cílené než studie na proteinových čipech. Výstupem těchto stanovení je skutečně kvantitativní určení koncentrace proteinu, na rozdíl od čipů, kde jsou výsledky často pouze kvalitativní nebo semikvantitativní.
Technologie FlowCytomix
Technologie Flow Cytomix je založena na sadě mikrokuliček o dvou velikostech (4 μm & 5 μm). Každá ze dvou velikostí mikrokuliček je dále rozlišena různými intenzitami fluorescenčního barviva. Na každé sadě mikrokuliček je navázána specifická protilátka, druhá protilátka je značená fykoerytrinem. Měření probíhá na běžném průtokovém cytometru a data se vyhodnocují speciálním programem. Toto uspořádání umožňuje stanovit zároveň koncentrace 20 analytů.
Technologie xMAP
Multi-analyte profiling technologie (xMAP) je založena na sadě 5,6 μm polystyrenových mikrokuliček. V této sadě je 100 populací mikrokuliček, které se liší vnitřním spektrálním kódem vytvořeným kombinací dvou fluorescenčních barviv v různém poměru. Multiplexová analýza je založena na specifických protilátkách navázaných na jednotlivé populace mikrokuliček. Protože jsou mikrokuličky rozlišené spektrálním kódem můžou být kombinovány v analýze a umožnují tak stanovení teoreticky až 100 analytů v jedné reakční jamce. Množství stanovovaného proteinu je určeno na základě druhé protilátky značené fluorescenční molekulou. Reakce tedy probíhá na principu sendviče.
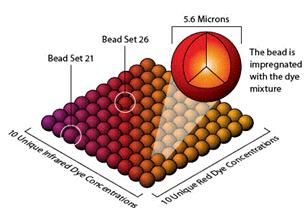
Obrázek 24. Rozlišení mikrokuliček pro xMAP technology (zdroj: www.panomics.com)
Měření probíhá na speciálním průtokovém cytometru - přístroj Luminex. Mikrokuličky z reakční jamky jsou nasáty do přístroje, kde protékají v nosném proudu jedna za druhou mezi dvěmi lasery. Fluorescenční signál po excitaci prvním laserem určuje spektrální kód kuličky – tedy druh měřeného analytu – a fluorescenční signál po excitaci druhým laserem určuje množství druhé protilátky, tedy množství analytu.
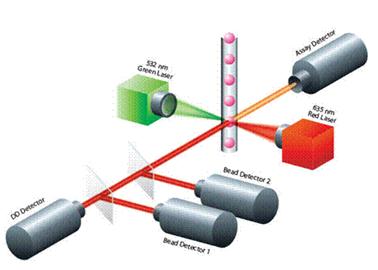
Obrázek 25. Princip xMAP měření ( zdroj obrázku www.panomics.com)
Pro imunochemickou reakci se používají mikrodestičky s filtračním dnem. Nenavázané látky se z reakce odmývají dnem destičky přes filtry, které udržují mikrokuličky s navázanými proteiny v jamce. Koncentrace jednotlivých analytů je vypočtena na základě kalibračních křivek zkonstruovaných pro každý měřený protein.
Všechny další imunoanalytické přístupy jsou také použitelné na xMAP platformě např. kompetitivní imunoanalýza, receptor-ligandová analýza nebo pro stanovení protilátek antigen navázaný na mikrokuličky. Kromě imunoanalytických stanovení umožňuje tato platforma také analýzu DNA nebo RNA molekul, které jsou přímo nebo po jejich amplifikaci multiplexově detekovány specifickými sondami vázanými na mikrokuličky.

Obrázek 26. Protilátky navázané na mikrokuličky s vyvázanými proteiny ze vzorku a po přidání značené druhé protilátky (zdroj obrázku www.rndsystems.com)
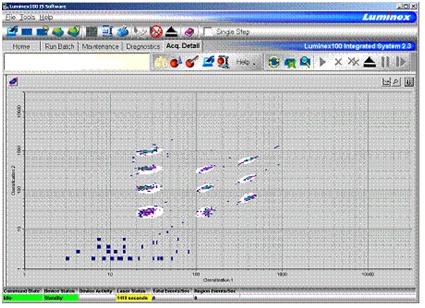
Obrázek 27. Příklad z měření xMAP technologií – Multiplexová analýza 10 cytokinů
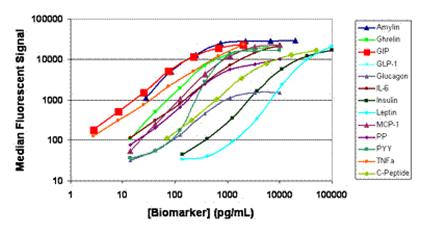
Obrázek 28. Kalibrační křivky pro 13-plex panel lidských hormonů (Zdroj: http://www.biotek.com/resources/articles/workflows-luminex-xmap-assays.html)
xMAP je otevřená technologie a v současnosti lze nakoupit reagencie pro imunoanalýzu od mnoha světových výrobců. Bohužel pro společné stanovení nelze kombinovat látky, které mají velmi odlišné biologické koncentrace, pokud jejich protilátky vykazují zkříženou reaktivitu a pokud mají příliš rozdílné požadavky na preanalytickou fázi.

Obrázek 29. Přístroj Luminex 100 (zdroj: www.luminexcorp.com)
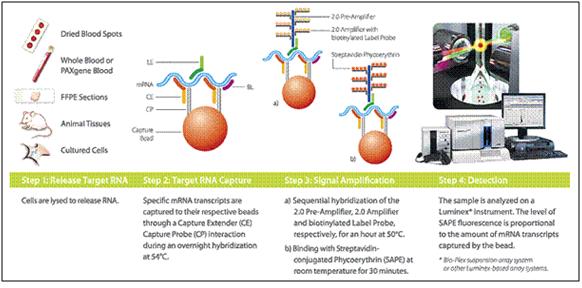
Obrázek 30. Princip přímé kvantifikace RNA na multiplexovém principu na Luminexové platformě (zdroj obrázku -www.panomics.com)
V současnosti jsou již k dispozici reangencie pro Luminexovou platformu obsahující magnetické mikrokuličky (MagPlex®), což umožňuje jednodušší separaci během reakčních kroků a především jejich automatizaci na jednoduchých promývacích stanicích nebo jako součást pipetovacích automatů.
FlexMAP technologie jako další generace multiplexových přístrojů od fy. Luminex umožňuje přidáním třetí rozlišovací barvy do mikrokuliček měření až 500 analytů zároveň v jedné analýze, což při použití 96-jamkové mikrotitrační destičky znamená možnost až 64000 testů za 45 minut.
Zcela novým konceptem od fy. Luminex je přístroj MAGPIX. Ten umožní měření až 50 testů současně v jednom reakčním objemu a měření na tomto přístroji je založeno na principu CCD zobrazovací technologie na rozdíl od přístrojů řady Luminex xMAP.
Laboratoř na čipu (Lab-on-a-chip)
S tlakem na vývoj point-of-care testů dochází k stále vyšší míře miniaturizace laboratorních technologií. Miniaturizace vede k finančním úsporám, šetří životní prostředí a vede k vyšší dostupnosti a mobilitě technologií. Miniaturizace vyžaduje úplnou integraci všech kroků v imunoanalytickém stanovení a její budoucnost je v kombinaci s multiplexovými technologiemi. Laboratoř na čipu (LOC) je zařízení, které integruje laboratorní postupy na ploše o velikosti milimetrů nebo několika málo čtverečných centimetrů. Často je využívána tzv. mikrofluidika neboli pohyb kapalin v prostorách mikro čipu. Aby mohl být mikrofludický obvod na čipu použit pro analýzu, musí obsahovat: mikroskopicky malé ventily (rozváděcí nebo uzavírací), mixéry pro míchání tekutin, mikroreaktory, senzory, oscilátory a výměníky tepla. Princip laboratoře na čipu je dnes aplikován pro miniaturizaci imunoanalýz, biochemických reakcí i PCR a dalších genetických technologií. Cílem miniaturizace je tzv. µTAS (micro total analysis system) – to je systém, který by integroval odebrání vzorku, transport a před analytickou úpravu vzorku, chemickou reakci a separaci i detekci reakce na jednom čipu .
Větším kolegou těchto technologií je systém Avantra, který umožňuje sendvičovou imunoanalýzu 40 analytů v jednom vzorku. Základem je běžný čip s naspotovanými protilátkami, který je ale uzavřen uvnitř plastické schránky/čipu (MAX BIOCHIP®) obsahujícího vše potřebné k analýze: kanálky, senzory, komory pro reagencie („Suché“ biotinylované protilátky, streptavidin, promývací pufr). Max biochip je vložen do přístroje a poté je nastříknut vzorek – samotným přístrojem neprotéká žádná tekutina, celá reakce probíhá uvnitř max biochipu. Vyhodnocení reakce probíhá CCD kamerou detekující signál ze spotů na čipu.
Literatura
- Kingsmore S.F. Multiplexed protein measurement: technologies and applications of protein and antibody arrays: Nature Reviews Drug Discovery 5 (4), pp. 310-320, 2006
- Moody, M.D., Van Arsdell S.W., Murphy K.P., Orencole S.F.,. Array-based ELISAs for high throughput analysis of human cytokines: BioTechniques (31)1, pp. 186-195, 2001
- Stoll D., Bachmann J., Templin M.F., Joos T.O., Microarray technology: an increasing variety of screening tools for proteomic research, Drug discovery today: Targets 3 (no.1), pp. 24-31, 2004
- Zhu H, Snyder M. Protein chip technology. Curr Opin Chem Biol. 2003 Feb;7(1):55-63. Review. PubMed PMID: 12547427.
- Poetz O., Schwenk J.M., Kramer S., Stoll D. et al., Protein microarrays: catching the proteome, Mechanisms of Ageing and Development 126, pp. 161-167, 2005
- http://www.raybiotech.com/protein_array.asp#3
- http://www.whatman.com/FASTQuant.aspx