Akutní leukémie
| Stránky: | POSTUDIUM |
| Kurz: | Hematoonkologie |
| Kniha: | Akutní leukémie |
| Vytiskl(a): | Nepřihlášený host |
| Datum: | pondělí, 21. dubna 2025, 06.47 |
Popis
Vhodné i jako materiál pro tisk.
1. Definice
Akutní leukémie je zhoubné onemocnění krvetvorby postihující buňky kostní dřeně. Vlastní příčina nemoci není zatím známa, ale je patrná souvislost s předchozí chemoterapií a ozářením a u pacientů s genetickými vadami (např. Downův syndrom, Klinefelterův syndrom a jiné...). V podstatě dojde ke zmnožení nezralých („dceřiných”) buněk kostní dřeně a tím dojde postupně k útlaku ostatních krvetvorných řad - zjednodušeně řečeno dceřiné buňky utlačí populaci mateřskou, která již dále nemůže plodit zdravé buňky. Bohužel dceřiné buňky jsou nevyspělé a tedy nefunkční, což vede k poruchám imunity, krevní srážlivosti a pod.
Nejvyšší výskyt nad 65 let věku (15-17/100 000), celkově je výskyt kolem 2-4/100 000 lidí. Je samozřejmě i rozdílný výskyt leukémií podle věku, např. ALL je typická pro dětský věk a má v mladším věku lepší prognózu.
2. Rozdělení leukémií dle morfologie
- Akutní myeloidní leukémie (AML) - nemoc vzniklá z granulocytární linie
- Akutní lymfoblastická leukémie (ALL) - nemoc vzniklá z lymfocytární linie
- Akutní bilineární leukémie (ABL) - vzácná, vzniká z obou linií najednou
2.1. Akutní myeloidní leukémie
Morfologická klasifikace dle FAB klasifikace - podtyp je určen tvarem a typem buňky z myeloidní linie - samotný podtyp (kromě M3) nemá příliš prognostický význam, jde jen o zařazení leukémie „podle vzhledu buněk”:
- M0 - AML s nediferencovanými blasty
- M1 - AML s myeloblasty bez patrného vyzrávání
- M2 - AML s myeloblasty s patrným vyzráváním - nejčastější typ
- M3 - promyelocytární AML (přítomnost promyelocytů), má i typické genetické změny, má velmi dobrou prognózu a jako jediná je léčitelná pouze chemoterapií (dlouhodobé přežívání po standardní chemoterapii je až 90%)
- M4 - AML myelomonocytární
- M5 - AML monocytární - blasty velké, bez granulí, odpovídají monocytární populaci
- M6 - erytroblastová AML (vznik z červené krevní řady) - vzácná
- M7 - megakaryoblastová AML (vznik z „destičkové“ řady) - vzácná
Novější klasifikace dle WHO zahrnuje morfologii, cytogenetiku a jiné související změny:
- AML s multilineární dysplazií - morfologicky znatelné dysplastické rysy vývoje krvetvorby (častěji u starších lidí)
- AML s rekurentními genetickými abnormalitami - AML s typickými genetickými změnami - např. M3 = translokace 15;17 a jiné - většinou dobrá prognóza
- AML asociovaná s terapií - AML vzniklá po předchozí chemoterapii nebo ozařování - horší prognóza
- AML blíže nezařazená - nelze blíže určit, zde přidáváme FAB klasifikaci
2.2. Akutní lymfoblastická leukémie
- L1 - ALL z malých lymfocytů/lymfoblastů
- L2 - ALL ze středně velkých lymfocytů/lymfoblastů
- L3 - Burkitoidní ALL- z velkých nepravidelných lymfocytů/lymfoblastů - vzácná - typická přítomnost vakuol (kulatých „bublinek” v cytoplazmě)
ALL z B buněčné řady - určeno podle flowcytometrického vyšetření, tento typ častější (cca 80-90 %), nejhorší variantou je současná přítomnost tzv. Philadelphského chromozomu - Ph pozitivní ALL (zde dochází k chromozomální přeměně na 9 a 22 chromozomu)
ALL z T buněčné řady- vzácnější, častější infiltrace CNS a orgánů
2.3. Jiné typy leukémií
- Sekundární leukémie – vzniklá po předchozí chemoterapii či ozařování
- Akutní leukémie při myelofibróze – zvýšená tvorba vaziva v kostní dřeni, ve které je zbytek buněk transformovaných v leukemické buňky
- Bilineární leukémie – tvořené z více zárodečných linií najednou
- Plasmocelulární leukémie – tvořená plasmatickými buňkami, velmi agresivní, špatně reagující na léčbu
- Vlasatobuněčná leukémie – nízce maligní lymfom, dobře reagující na léčbu
3. Příznaky
Klinické příznaky jsou způsobeny nepřítomností zdravých krevních elementů a dále také jejich útlakem v kostní dřeni. Pro leukémie je velmi typické, že klinický stav se poměrně rychle zhoršuje a není výjimkou úmrtí na závažné komplikace v řádu dnů. Velmi nebezpečná je klinicky nezjistitelná hyperleukocytóza (cca nad 100 ×109/l ) - velmi vysoké riziko udušení v důsledku „ucpání“ drobných kapilár v plicním řečišti.
Příklad: Pacient dochází k praktickému lékaři s opakovanými angínami, které nereagují na podávaná antibiotika, navíc se k tomu přidá „praskání“ koutků a afty.Z důvodu snížené tvorby krevních destiček jsou patrné četné hematomy či drobná prokrvácení tkání - nejčastěji postižena kůže končetin, u žen prodloužená či extrémně silná menstruace.
Příklad: Typický pacient při záchytu nemoci velmi často s četnými modřinami na těle vzniklými po sebemenším násilí.V kostní dřeni dochází k útlaku tvorby červené krevní řady a tím pak k projevům anemického syndromu (tj. z nedostatku červeného krevního barviva) - tomu odpovídá únava, slabost, malátnost, bledost.
Mezi méně časté projevy patří hyperplazie (zduření) dásní, zduření lymfatických uzlin či jater, krvácení do CNS (centrální nervový systém - sem patří mozek a mícha) nebo do sítnice, zduření varlat při infiltraci (častěji u ALL)
Specifické projevy při infiltraci CNS (bývá u ALL) - bolesti hlavy, točení hlavy, závratě, poruchy hlavových nervů (např. náhle vzniklé šilhání) - proto u každé diagnózy ALL provádíme lumbální punkci s aplikací chemoterapie do páteřního kanálu - při potvrzení leukémie i v mozkomíšním moku nutné opakované aplikace.
4. Diagnostika
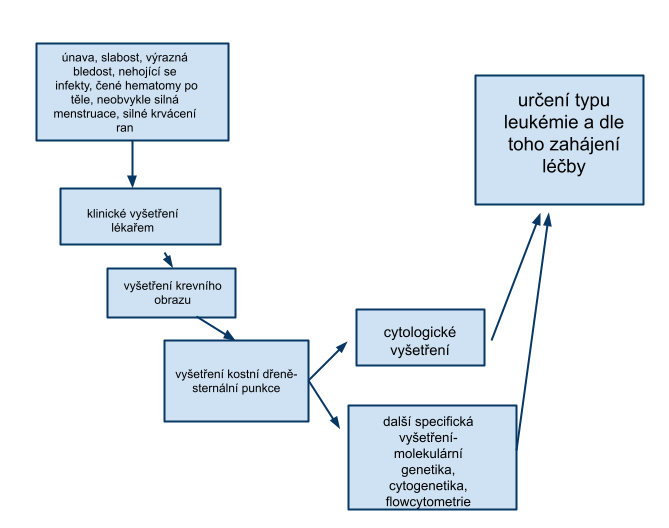
4.1. Klinické a laboratorní vyšetření
Klinické vyšetření
Pacienti většinou bývají velmi bledí, unavení, na těle patrné četné hematomy, prokrvácené sliznice, může být i teplota či jiný projev probíhající infekce. Velmi nebezpečné je patrné „dušení” při velmi vysokém počtu bílých krvinek jako příznak „ucpání” drobných cév v plicích. U ALL mohou být zvětšené mízní uzliny či slezina, navíc při infiltraci CNS mohou být i příznaky jeho postižení (závratě, točení hlavy, poruchy motoriky nebo mluvení).Vyšetření periferní krve
Základním vyšetřením je vyšetření krevního obrazu včetně diferenciálního rozpočtu. Nejčastěji bývá přítomna leukocytóza (nad 10 × 109/l), méně často leukopénie nebo naprosto normální hladina leukocytů. Důležitý je proto diferenciální rozpočet, kde v 95 % případů jsou zastižitelné blasty, tj. nezralé buňky. Jen v malém procentu tyto blasty nezachytíme - většinou se skrývají pod skupinou lymfocytů (při malobuněčné ALL), prolymfocytů (u AML M3) či plasmocytů (plasmocelulární leukémie). Také bývá poměrně typický hiatus leucaemicus, což znamená chybění vývojových forem granulocytů jako jsou myelocyty a metamyelocyty - jsou zde přítomny tedy jen blasty jako nezralá varianta buněk a pak rovnou segmenty jako zralé elementy.4.2. Sternální punkce, trepanobiopsie
Vyšetření kostní dřeně – tzv. sternální punkce. Provádí se v místním znecitlivění z hrudní kosti (méně často ze zadních hrbolů kosti pánevní) s odběrem několika mililitrů kostní dřeně. Variantou je i provedení trepanobiopsie, odběr několikamilimetrového válečku kosti z kosti pánevní na podrobné histologické vyšetření (jen v případě, že není nález v krevním obraze dostatečně jistý či potřebujeme vyloučit jiné onemocnění kostní dřeně – např. útlum kostní dřeně, infiltraci lymfomem).4.3. Hodnocení v morfologické laboratoři
- Cytologické vyšetření – morfologické zhodnocení nátěrů na sklíčku - jaké jsou tam buňky, jaká je buněčnost nátěru, jiné patologie.
- Cytochemické vyšetření – dnes již téměř nepoužíváno z důvodu velké pracnosti a obtížné interpretovatelnosti (toto nahrazeno genetickými a dalšími metodami) - dnes POX vyšetření na přítomnost myeloperoxidázy a barvení na Fe ke zhodnocení zásob Fe v kostní dřeni, další obsolentní (barvení se súdánskou černí, PAS reakce, nespecifická esteráza...)
- Flowcytometrické vyšetření – pomocí laserových paprsků určuje velikost, granularitu buněk a jejich typické povrchové znaky (tzv. CD znaky)
- Molekulárně genetické vyšetření - vyšetření specifických změn na úrovní DNA, důležité pro stanovení prognózy. Mezi typické patří bcr-abl (Ph pozitivní ALL), aml-eto (příznivější AML) a jiné
- Cytogenetické vyšetření – vyšetření podobné molekulárně genetickému, ale zde je vše na úrovni chromozomů. Opět slouží ke stanovení prognózy a také ke sledování poklesu patologické populace (např. při diagnóze 90 % patologických chromozomů s t(9;22), po ukončení léčby jen 10 %). Mezi častější patří t(9;22) - Ph pozitivní ALL, inv(16) – příznivější AML, t(4;11) - velmi nepříznivá ALL a jiné. Podskupinou cytogenetického vyšetření je tzv. FISH (fluorescenční hybridizace) – chromozomy se značí fluoreskujícími sondami a ty jsou pak viditelné mikroskopem.
5. Diferenciální diagnostika
Jaké stavy mohou mít podobné klinické či laboratorní příznaky? Důležité je komplexní zhodnocení nálezů - tzn. klinika + laboratoř + ostatní vyšetření
5.1. Leukopénie- pokles leukocytů pod 4 × 109/l, méně častá varianta
- Aplastická anémie- v podstatě útlum kostní dřeně, chybí zde všechny krevní složky (v KO např. leuko 1,4 × 109/l, hemoglobin 74 g/l, trombo 45 × 109/l, bez blastů v differenciálu) - odlišení podrobným vyšetřením kostní dřeně včetně trepanobiopsie, nejsou zde blasty
- Léky způsobené poškození kostní dřeně - vypadá stejně jako aplastická anémie, ale v anamnéze je patrné užívání toxických léků - typicky methotrexát, některá antiepileptika...
- Myelodysplastický syndrom (MDS) - porucha vyzrávání kostní dřeně - v KO opět pokles častěji ve více řadách, odlišíme opět vyšetřením kostní dřeně - zde hranice počtu blastů max. do 20 %
- Některé lymfomy - např. hairy cell leukémie = vlasatobuněčná leukémie - vzácnější onemocnění
5.2. Leukocytóza- zvýšení leukocytů nad 10 × 109/l, častější varianta
- Infekční stavy, sepse - dochází ke zvyšování hlavně leukocytů, později i trombocytů, v diferenciálu by neměly být blasty, je naopak velmi četné zastoupení tyčí a segmentů
- Myeloproliferativní onemocnění (např. chronická leukémie) - zde většinou výrazný nárůst leukocytů (např. až 450 × 109/l),s přítomností všech vývojových variant v diffu (myelocyty, metamyelocyty aj.), blasty tvoří do 5 % celkové buněčnosti
- Myelodysplastický syndrom (MDS) - porucha vyzrávání kostní dřeně - v KO opět pokles častěji ve více řadách, odlišíme opět vyšetřením kostní dřeně - zde hranice počtu blastů max. do 20 %
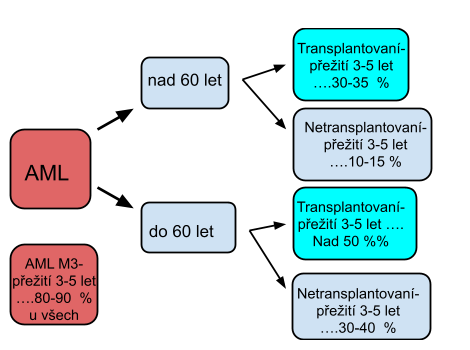
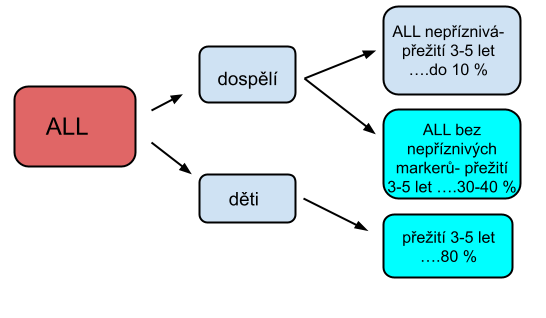
6. Prognostické faktory
Jedná se o znaky vyskytující se v morfologickém, flowcytometrickém nebo genetickém vyšetření. Tyto faktory se vyšetřují vždy při záchytu nemoci, většinou hromadným vyšetřením (např. při záchytu akutní myeloidní leukémie se provede panel pro AML obsahující cca 15 typů prognostických znaků). Dle výsledků pak určujeme další postup a typ léčby.
Např.:
- 60letý pacient s novou AML - vyjdou nepříznivé prognostické markery, pacient s více nemocemi - nezahajujeme intenzivní léčbu, pouze dle potíží nemocného
- 62letý pacient s AML – vyjdou pozitivní znaky – zde naopak zahájíme intenzivní léčbu s cílem pacienta vyléčit
Není důležité jak je pacient starý, ale důležité je dát dohromady věk, celkovou kondici pacienta, přidružené choroby a samozřejmě výsledek vyšetření.

7. Léčba
7.1. Chemoterapie kurativní
Jedná se o léčbu, kdy se snažíme maximální možnou cestou o úplné vyléčení pacienta. Platí pro mladé, perspektivní pacienty, cca do 60-65 let s dobrou kvalitou života. Tato léčba je velmi intenzivní a má řadu komplikací a měla by být zahájena v řádu dnů od zjištění diagnózy.
Indukční fáze:
První část, kdy je cíl dosáhnout kompletní remise, tj. stav, kdy původní nemoc není detekovatelná morfologickými metodami. Tím dojde k možnosti regenerace původní zdravé krvetvorby a k normalizaci krevního obrazu. Chemoterapie je několikasložková – obsahuje kombinaci několika cytostatik1. Trvá 28 dnů.
Během prvního týdne léčby dojde k prudkému rozpadu leukemických buněk, což může vést k řadě komplikací (horečky, třesavky, selhání ledvin...) až leukocyty klesnou pod 1 × 109/l, klesá i hladina hemoglobinu pod 80 g/l a trombocytů pod 10 ×109/l. V tuto dobu je pacient velmi ohrožen infekcemi a krvácením a v tuto dobu je nutné podávání krevních a destičkových transfúzí. Nejvyšší riziko je v prvních 3 týdnech, kdy je hladina leukocytů trvale pod 1 × 109/l. Koncem 3. týdne léčby dochází k postupné spontánní reparaci krvetvorby a postupné normalizaci krevního obrazu - viz tabulka. Ideálně dojde v den +28 od zahájení léčby k úplnému zahojení, zjišťujeme normální krevní obraz a v kostní dřeni je do 5 % blastů.
V případě ALL je ještě standardní podávání chemoterapie do páteřního kanálu minimálně vstupně - při prokázané nemoci v CNS ještě několikrát poté (cca po 2-3 týdnech).
Konsolidační fáze:
----------
1pro AML standardní protokol „7+3”, tj. 3 dny idarubicin, 7 dnů kontinuálně cytosin arabinosid
pro AML M3 protokol AIDA idarubicin + vesanoid
pro ALL standardní protokol hyperCVAD doxorubicin, vincristin, cyclophosphamid, dexamethazon
7.2. Chemoterapie paliativní
Paliativní léčbou rozumíme léčbu, která není léčebná, ale pouze pacientovi zlepšuje kvalitu života.
Malé dávky cytostatik – podkožně aplikujeme malé dávky chemoterapie
Podávání kortikoidů – způsobí částečný rozpad maligních buněk a ústup potíží
Podávání pouze krevních a destičkových transfúzí – předcházíme rozvoji anemických potíží a většího krvácení.
7.3. Transplantace kostní dřeně
Nejmodernější typ léčby, který jako jediný umožňuje úplné vyléčení. Nevýhodou je velmi vysoká zátěž organismu, asi 30% riziko úmrtí na časné komplikace (infekce, krvácení...). Indikováno u perspektivních pacientů cca do 60-65 let.
Autologní transplantace – u leukémií vzácně používaná, jedná se o podání vlastní kostní dřeně odebrané po ukončení vstupní léčby
Alogenní transplantace – příbuzenská (od shodného dárce v rodině) či nepříbuzenská
Existují 2 varianty transplantace – podání kostní dřeně (odběr od dárce asi 1,5 litru kostní dřeně v celkové narkóze z pánevních kostí) nebo podání krvetvorných buněk (dárce si aplikuje podkožně 5 dnů růstový faktor krvinek, tzv. G-CSF, kdy dojde k vyplavení „kostní dřeně” do krve a pak podobně jako při odběru transfúze se odeberou pomocí separátoru pouze krvetvorné buňky - asi 200-300 ml). Vždy záleží na dárci, kterou metodu upřednostní, vše má své výhody i nevýhody. Vlastní podání pacientovi pak probíhá formou infúze těchto odebraných krvinek.
Výběr dárce
Po odběru 2-5 ml periferní krve se vyšetřují základní DNA znaky – pro naše účely 10 základních znaků (každý člověk má 5 znaků od otce a 5 znaků od matky). Tytéž znaky jsou již vyšetřeny u pacienta. Pro výběr dárce jsou nutná tato kritéria: co nejvyšší shoda - ideálně 100% (nejhůře lze využít shodu 80%, tzn. 8 čísel z 10, ale je to spojeno s vyšším rizikem komplikací), mužské pohlaví (ženy se „imunizují” těhotenstvími a tím je pak vyšší riziko imunitních komplikací u pacienta), vyšší hmotnost (přepočítáváme vždy na kg pacienta, je tedy lepší „hodně buněk od velkého dárce” než „málo buněk od malého člověka“), krevní skupina (je upřednostňována shodná krevní skupina, ale není to nezbytné).Pokud jsou mezi dárcem a pacientem rozdíly mezi krevními skupinami, dochází po vlastní transplantaci k přeměně krvinek a několik měsíců poté se mění krevní skupina podle dárce.
Šance na nalezení příbuzného dárce je cca 25 % , přičemž dárcem může být pouze vlastní sourozenec – má stejné geny od stejné matky i otce - děti i rodiče mají již pouze polovinu shodných genů.
Šance na nalezení nepříbuzného dárce je velmi individuální, nyní zhruba 80 % pacientů dárce najde (ať příbuzného či nepříbuzného).
Z nejzávažnějších reakcí po transplantaci je tzv. GvHD, graft versus host disease neboli reakce štěpu proti hostiteli. Za normálních okolností organismus vnímá své tělo a buňky a cokoliv cizího se snaží odbourat nebo zničit. Jelikož transplantovaná tkáň je cizí i v případě sourozence, tak tělo to vnímá jako cizí a snaží se toto odstranit. Tuto reakci my potlačujeme podáváním imunosupresivních léků (cyklosporin) snižujících imunitní reakce. A právě tehdy, kdy je potlačena vlastní imunita, začnou naopak reagovat transplantované buňky, kterým se nové tělo zdá „cizí” a začnou tvořit protilátky či reakce ke zničení tkáně. Mezi nejčastější varianty GvHD patří kožní vyrážky, vodnaté průjmy, poškození plic (dušnost, horší dýchání), zhoršení jaterních testů, horečky...na druhou stranu malá forma GvHD je výhodná jako obrana proti původní nemoci (nové buňky by původní nemoc braly jako cizí), takže se snažíme o vybalancování.
S ohledem na velmi sníženou imunitu jsou pacienti velmi ohroženi jakoukoliv infekcí, proto dlouhodobě podáváme antibiotika a samotní pacienti se musí vyhýbat infekčnímu prostředí.
8. Prognóza leukémií
Prognóza leukémií je dána rizikovými faktory uvedenými výše.